
【题目】框图中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。

请问答下列问题:
(1)反应①﹣⑤中,既属于氧化还原反应又属于化合反应的是_____(填序号)
(2)反应⑤的化学方程式为_______________________________________
(3)甲与B反应的离子方程式________________________________________
(4)在实验室将C溶液滴入F溶液中,观察到的现象是____________________________________
(5)在F溶液中加入等物质的量的A,A体现的性质为_____________________________________
【答案】①⑤ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Na+2H2O=2Na++2OH﹣+H2↑ 先生成白色沉淀,然后迅速变为灰绿色,最终变为红褐色 氧化性、还原性
【解析】
甲、乙为单质,二者反应生成A为淡黄色固体,则A为Na2O2,甲、乙分别为Na、氧气中的一种;B为常见液态化合物,与A反应生成C与乙,可推知B为H2O、乙为氧气、C为NaOH,则甲为Na;F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色,则G为FeCl3,F为FeCl2,结合转化关系可知,E为Fe(OH)3,D为Fe(OH)2,据此分析解答。
根据以上分析可知甲为Na,乙为氧气,A为Na2O2,B为H2O,C为NaOH,D为Fe(OH)2,E为Fe(OH)3,F为FeCl2,G为FeCl3,则
(1)反应①~⑤中,①②⑤属于氧化还原反应,③④属于非氧化还原反应;①⑤属于化合反应。故既属于氧化还原反应又属于化合反应的是①⑤;
(2)反应⑤的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(3)甲与B反应即钠与水反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑。
(4)将NaOH溶液滴入FeCl2溶液中,先生成氢氧化亚铁沉淀,再被氧化生成氢氧化铁,因此观察到的现象是:先生成白色沉淀,然后迅速变为灰绿色,最终变为红褐色。
(5)在FeCl2溶液中加入等物质的量的Na2O2,发生反应的总的离子方程式为:4Fe2++4Na2O2+6H2O=4Fe(OH)3+8Na++O2↑。所以根据生成物有氢氧化铁和氧气可知过氧化钠中氧元素化合价既升高又降低,则过氧化钠体现的性质为氧化性、还原性。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】金属钛(Ti)的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸浸钛铁矿(其主要成分为钛酸亚铁(FeTiO 3它难溶于水,但能与酸反应)的方法制取二氧化钛 ,再由二氧化钛 制取金属钛。工艺流程如下:

回答下列问题
(1) FeTiO3中钛元素的化合价为____。
(2)稀硫酸与FeTiO3反应的离子方程式为:____。
(3)过程V表现了金属镁的还原性比金属钛的还原性____(填“强”或“弱”)。
(4)写出过程IV的化学方程式____(注意焦炭过量)。
(5)酸浸中,铁的浸出率与时间、温度的关系如图所示,如图可知,当铁的浸出率为70%时,可采用的实验条件为____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下试剂的保存方法,其中不能用氧化还原反应解释的是( )
A. 钠保存在煤油中 B. 氯水保存在棕色的试剂瓶中
C. 保存FeSO4溶液需加入少量铁粉 D. 盛装NaOH溶液的试剂瓶不能用玻璃塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是( )
A. 烧碱、液态氧、干冰 B. 生石灰、白磷、漂白粉
C. 氯水、铁红、氯化氢 D. 空气、氮气、胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧族元素和卤族元素都能形成多种物质,我们可以利用所学物质结构的相关知识去认识和理解。
(1)H+可与H2O形成H3O+,H3O+ 立体构型为_________。H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角大,原因为_________________________________________。
(2)COCl2的空间构型为____________;溴的价电子排布式为________________。
(3)根据已经掌握的共价键知识判断,键的极性F-H _______ O-H(“>”,“=”或“<”)
(4)溴化碘和水反应生成了一种三原子分子,该分子的结构式为____________________ ,中心原子杂化轨道类型为________________。
(5)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是________。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(6)下列分子既不存在sp σ键,也不存在pp π键的是________。
A.HCl B.HF C.SO2 D.SCl2
(7)ClO2-立体构型为____________,写出与ClO2-互为等电子体的一种分子为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】拟用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。下列可以得到干燥纯净的气体的选项是( )

选项 | 气体 | a | b | c | d |
A | CO2 | 盐酸 | CaCO3 | 饱和Na2CO3溶液 | 浓硫酸 |
B | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
C | Cl2 | 浓盐酸 | MnO2 | 饱和NaCl溶液 | 浓硫酸 |
D | NO2 | 浓硝酸 | 铜屑 | H2O | 固体NaOH |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
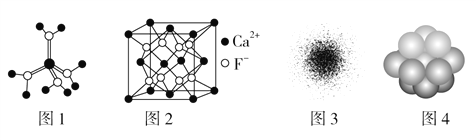
A. 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图3所示,H原子核外大多数电子在原子核附近运动
D. 金属铜中Cu原子堆积模型如图4为最密堆积每个Cu原子的配位数均为12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com