
【题目】金属钛(Ti)的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸浸钛铁矿(其主要成分为钛酸亚铁(FeTiO 3它难溶于水,但能与酸反应)的方法制取二氧化钛 ,再由二氧化钛 制取金属钛。工艺流程如下:

回答下列问题
(1) FeTiO3中钛元素的化合价为____。
(2)稀硫酸与FeTiO3反应的离子方程式为:____。
(3)过程V表现了金属镁的还原性比金属钛的还原性____(填“强”或“弱”)。
(4)写出过程IV的化学方程式____(注意焦炭过量)。
(5)酸浸中,铁的浸出率与时间、温度的关系如图所示,如图可知,当铁的浸出率为70%时,可采用的实验条件为____。

【答案】+4 FeTiO3 + 4 H+ =Fe2+ +TiO2+ +2H2O 强 TiO2 +2 Cl2 + C![]() TiCl4 +2CO 100摄氏度2h 或 90摄氏度 5h
TiCl4 +2CO 100摄氏度2h 或 90摄氏度 5h
【解析】
(1)根据化合物中正负价代数和为0解答;
(2)根据流程图中元素的存在形式判断生成物;
(3)根据活泼的金属能置换出不活泼的金属判断;
(4)TiO2与氯气、焦炭在高温下反应生成四氯化钛、CO,据此书写;
(5)根据图像结合浸出率判断需要的温度和时间。
(1)FeTiO3中Fe是+2价,O是-2价,所以根据化合物中正负价代数和为0钛元素的化合价为+4价。
(2)根据流程图可知加入稀硫酸后有亚铁离子和TiO2+生成,则稀硫酸与FeTiO3反应的离子方程式为FeTiO3+4H+=Fe2++TiO2++2H2O。
(3)过程V中金属镁和四氯化钛发生置换反应生成金属Ti和氯化镁,则表现了金属镁的还原性比金属钛的还原性强。
(4)过程IV中焦炭过量,则碳转化为CO,所以反应的化学方程式为TiO2+2Cl2+C![]() TiCl4+2CO。
TiCl4+2CO。
(5)由图可知,当铁的浸出率为70%时,所采用的实验条件为选择温度为100℃、2h或90℃、5h。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 冶铝工业中,采用铁作阳极,碳作阴极
B. 硫酸工业中,采用低温条件来提高SO2的转化率
C. 合成氨工业中,将氨气液化分离来增大正反应速率
D. 氯碱工业中,采用阳离子交换膜防止OH-与阳极产物Cl2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含1 mol复盐NH4Al(SO4)2稀溶液中加入Ba(OH)2溶液,若生成l.6 mol BaSO4沉淀,则生成NH3·H2O的物质的量为( )
A. 0 mol B. 0.2mol C. l mol D. 0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法中错误的是( )
物质 | 杂质 | 除杂质的方法 | |
A | SiO2 | CaCO3 | 过量稀硫酸、过滤 |
B | 铜粉 | 铝粉 | 过量CuCl2溶液、过滤 |
C | FeCl3溶液 | FeCl2 | 通入适量氯气 |
D | SO2 | HC1 | 通过NaHSO3溶液的洗气瓶 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把少量废铁屑溶于过量稀硫酸中,过滤,除去杂质,在滤液中加入过量氯水,再加入过量的氨水,有沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到固体残渣。上述沉淀和残渣分别为
A. Fe(OH)2 ;Fe2O3 B. Fe(OH)2;FeO
C. Fe(OH)2、Fe(OH)3;Fe2O3 D. Fe(OH)3;Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH物质的量之比为
A. 3:1 B. 2:1 C. 1:1 D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由化合物A制备一种医药合成中间体G和可降解环保塑料PHB的合成路线如下:
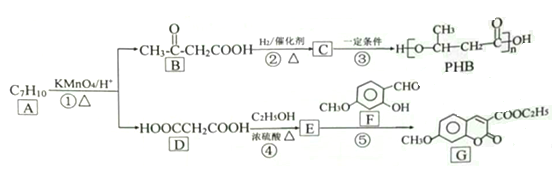
己知: ![]() (-R1、-R2、-R3均为烃基)
(-R1、-R2、-R3均为烃基)
回答下列问题:
(1)A的结构简式___________,G中含氧官能团的名称____________________。
(2)反应①和③的反应类型分别是_____________、________________。
(3)C存在多种同分异构体,其中分别与足量的NaHCO3溶液和Na反应产生气体的物质的量相同的同分异构体的数目为______种。
(4)写出反应③的化学方程式__________________________________
(5)写出满足下列条件的B的同分异构体_________________________
①能发生银镜反应 ②分子中烃基上的氢原子被取代后的一氯代物只有一种
(6)写出用B为起始原料制备高分子化合物![]() 的合成路线(其
的合成路线(其
他试剂任选)。____________________________________________
(7)上述合成路线中最后一步反应的化学方程式为:______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性无色透明溶液中,下列各组离子能大量共存的是( )
A. Fe3+、K+、Cl-、MnO4- B. Ag+、Na+、NO3-、AlO2-
C. Zn2+、Al3+、SO42-、Cl- D. Ba2+、NH4+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】框图中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。

请问答下列问题:
(1)反应①﹣⑤中,既属于氧化还原反应又属于化合反应的是_____(填序号)
(2)反应⑤的化学方程式为_______________________________________
(3)甲与B反应的离子方程式________________________________________
(4)在实验室将C溶液滴入F溶液中,观察到的现象是____________________________________
(5)在F溶液中加入等物质的量的A,A体现的性质为_____________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com