
【题目】将0.3 molMnO2和100mL 12 mol/L的浓盐酸混合后缓慢加热,充分反应后向留下的溶液中加入足量的AgNO3溶液,生成AgCl沉淀的物质的量为(不考虑HCl的挥发)( )
A. 等于0.6molB. 小于0.6mol
C. 大于0.6mol,小于1.2molD. 以上结论都不正确
【答案】C
【解析】
n(MnO2)=0.3mol,n(HCl)=0.1L×12mol/L=1.2mol,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,根据方程式可知0.3molMnO2反应需要HCl为0.3mol×4=1.2mol,若MnO2与盐酸能恰好完全反应,则生成氯气为1.2mol×
MnCl2+Cl2↑+2H2O,根据方程式可知0.3molMnO2反应需要HCl为0.3mol×4=1.2mol,若MnO2与盐酸能恰好完全反应,则生成氯气为1.2mol×![]() =0.3mol,溶液剩余Cl-为1.2mol-0.3mol×2=0.6mol,但MnO2只与浓盐酸反应生成氯气和氯化锰,随着盐酸浓度的降低,HCl的还原性减弱,反应停止,所以溶液中剩余Cl-大于0.6mol,则反应完全后向剩余的溶液中加入足量AgNO3溶液生成AgCl沉淀的物质的量大于0.6mol,小于1.2mol。
=0.3mol,溶液剩余Cl-为1.2mol-0.3mol×2=0.6mol,但MnO2只与浓盐酸反应生成氯气和氯化锰,随着盐酸浓度的降低,HCl的还原性减弱,反应停止,所以溶液中剩余Cl-大于0.6mol,则反应完全后向剩余的溶液中加入足量AgNO3溶液生成AgCl沉淀的物质的量大于0.6mol,小于1.2mol。
答案选C。


科目:高中化学 来源: 题型:
【题目】国家实施“青山绿水工程”,大力研究脱硝和脱硫技术。
(1)H2在催化剂作用下可将NO还原为N2。下图是该反应生成1mol水蒸气的能量变化示意图。写出该反应的热化学方程式________________________________。


(2)臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:
N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:
容器 | 甲 | 乙 |
容积/L | 1 | 1 |
温度/K | T1 | T2 |
起始充入量 | lmolO3 2mol NO2 | lmolO3 2mol NO2 |
①0-10min内甲容器中反应的平均速率:v(O3) =_______mol·L-1·min-1 。
②T1________T2 (填“>”“<”或“=”),T1时,该反应的平衡常数K的值为____________。
③下列措施能提高容器乙中NO2转化率的是________(填序号)。
A.向容器中充入He,增大容器的压强 B.升高容器的温度
C.向容器中再充人一定量的NO2 D.向容器中再充入lmol O3和2mo NO2
④T1时,若起始时向容器甲中充入2mo1 NO2、lmolO3、2mollN2O5和2molO2,则脱硝反应达到平衡前,v(正)________v(逆) (填“>”“<”“=”)。
(3)废水处理时,通H2S(或加S2-)能使某些金属离子生成极难溶的硫化物而除去。25°℃,某废液中c(Mn2+)=0.02mol·L-1,调节废液的pH使Mn2+开始沉淀为MnS时,废液中c(H2S)=0.1mol·L-1,此时pH约为___________。(已知:Ksp(MnS)=5.0×10-14,H2S的电离常数:K1=1.5×10-7,K2=6.0×10-15,1g6=0.8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是()
A. 制备Fe(OH)3胶体:向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液
B. 为了除去乙醇中的少量水,可向其中加入CaO,然后再蒸馏
C. 用瓷坩埚高温熔融Na2CO3固体
D. 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生用下图所示装置进行实验。以探究苯与溴发生反应的原理并分离提纯反应的产物。

请回答下列问题:
(1)写出装置Ⅱ中发生的主要化学反应方程式____________________________,其中冷凝管所起的作用为导气和________,Ⅳ中球形干燥管的作用是__________。
(2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。Ⅲ中小试管内苯的作用是_________________________。
(3)能说明苯与液溴发生了取代反应的现象是______________________。
(4)纯净的溴苯是无色油状的液体,这个装置制得的溴苯呈褐色,原因是里面混有溴,将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。①用蒸馏水洗涤,振荡,分液;②用______洗涤,振荡,分液;③再用蒸馏水洗涤,振荡,分液;④加入无水氯化钙干燥⑤蒸馏。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用如下装置所示方法制备氯气:
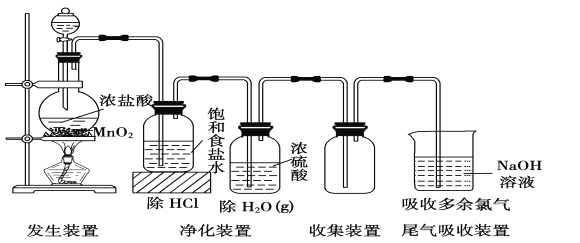
(1)1molMnO2和4mol浓盐酸制得的氯气的产量往往远低于1mol,原因可能是_________________;
(2)若改用NaCl固体、浓硫酸和MnO2一起加热,理论上氯元素利用率可以达到100%,试用化学反应方程式表示原因____________________________________;
(3)若在分液漏斗下方接一段毛细管插入圆底烧瓶底部,不需加热也可获得均匀稳定干燥的氯化氢气流,则分液漏斗和圆底烧瓶中应该盛放的试剂分别是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列变化一定加入还原剂才能实现的是______________(填序号)
①Fe2+→Fe ②CO2→HCO3-③ MnO4-→Mn2+ ④SO2→SO3 ⑤KMnO4→MnO2 ⑥ HCl→Cl2 ⑦SO32-→SO2 ⑧NH4+→NH3
(2)我国古代四大发明之一的黑火药是由硫粉、硝酸钾和木炭按一定比例混合而成,爆炸时的反应为S+ 2KNO3 +3C = K2S + N2↑ + 3CO2↑,反应中被还原的物质是 ___________(填化学式)
(3)NaH可在野外作生氢剂,反应原理为NaH + H2O = NaOH + H2↑,该反应中氧化产物和还原产物的质量比为____________ 。
(4)2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl2 +5Cl2↑ + 8H2O,用单线桥标出电子转移的方向和数目__________;HCl表现出的性质是 ___________________。
(5)取300mL 0.2mol· L-1的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量是 _________mol。
(6)为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1g样品加热,其质量变为w2 g,则该样品的纯度(质量分数)是______________ (用含w1和w2的式子表示)。
(7)取50mL含Na2CO3和Na2SO4的混合溶液与过量盐酸反应,生成2.24L CO2(标准状况),然后加入足量的Ba(OH)2溶液,得到的沉淀的质量为2.33g。试计算原混合溶液中Na+的物质的量浓度______ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】凯夫拉是一种高强度、耐腐蚀的芳纶纤维,军事上称为“装甲卫士”,但长期浸渍在强酸或强碱中强度有所下降。下表中是凯夫拉的两种结构:
| 芳纶1313(PMTA) | 芳纶1414(PPTA) |
结构 简式 |
|
|
以下说法不正确的是
A. PMTA和PPTA互为同分异构体
B. “芳纶1313”、“芳纶1414”中的数字表示苯环上取代基的位置
C. 凯夫拉在强酸或强碱中强度下降,可能与“![]() ”的水解有关
”的水解有关
D. 以![]() 和
和![]() 为原料制备PPTA的反应为缩聚反应
为原料制备PPTA的反应为缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过二硫酸钾(K2S2O8)是白色晶体、无味、易潮解、不稳定,是重要的氧化剂,用途广泛。
回答下列问题:
(1)过二硫酸钾的结构探究
过二硫酸钾中含有-1、-2价的氧元素,-l、-2价 氧的原子个数之比为____。
(2)过二硫酸钾的制取探究
过二硫酸钾可采用电解硫酸和硫酸钾的混合物制取,装置如图。阳极的电极反应为____,阴极区pH将____(填“增大”“减小”或“不变”)。

(3)过二硫酸钾的性质探究
①取硫酸锰溶于试管中,滴入K2S2O8溶液,溶液呈紫红色,K2S2O8的还原产物为SO42-,该反应的离子方程式为____。
②取过二硫酸钾装入硬质玻璃管中,加热,分解产生的气体依次通过装置B、C、D。实验发现B中产生白色沉淀,C中溶液颜色无明显变化现象;用带火星的木条靠近D中的 a,木条复燃。

有同学认为依据上述实验现象,可以判断过二硫酸钾热分解产生了SO3和O2、而没有产生SO2,据此得出过二硫酸钾分解反应的化学方程式为____。有同学认为仅依据上述实验现象,所得气体除可能是SO3与O2的混合物外,还可能是 ___或 ___的混合物。为确定过二硫酸钾分解所得混合气体中是否含有SO3,可将上述实验中装置B整体更换为 ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①CO(g)+CuO(s)![]() CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s)![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=c(CO2).c(Cu)/c(CO).c(CuO)
B. 反应③的平衡常数K=K1/K2
C. 对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com