
(16分)氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。某化学兴趣小组同学对氯气的性质进行如下探究:
(1)兴趣小组同学按下图装置进行实验,探究Cl2的漂白性。
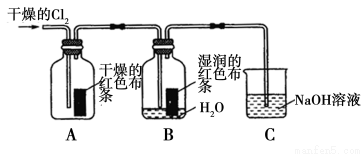
①通入Cl2后,观察到的现象是 根据现象可得出的结论是______。
②集气瓶B发生反应的离子方程式是______。
③C装置的作用是______,若有2.24 L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子数为________mol。
(2)兴趣小组同学按下图装置进行实验,探究Cl2的氧化性。
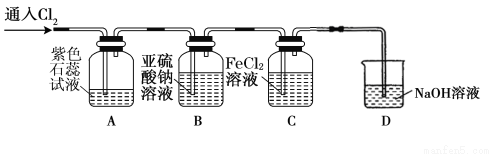
①实验开始后,观察装置A中的现象是: 。
②装置C中发生反应的离子方程式是 。
③停止通入氯气,取装置B中少量溶液于洁净的试管中,向其中滴加足量稀盐酸,再向其中滴加氯化钡溶液,有白色沉淀生成。则通入Cl2时装置B中发生反应的离子方程式是 。
(1)①干燥的有色(或A中)布条不退色,湿润的有色(或B中)布条退色Cl2无漂白性,Cl2与水反应生成的HClO有漂白性
②Cl2 + H2O = H+ + Cl-+HClO
③吸收氯气,防止环境污染 0.1
(2)①溶液先变为红色,然后退色。
②2Fe2++Cl2===2Fe3++2Cl- ③SO32-+Cl2=== SO42-+2Cl-
【解析】
试题分析:(1)①实验目的为探究Cl2的漂白性,干燥的氯气没有漂白性,Cl2 + H2O = H Cl+HClO,HClO具有漂白性;干燥的有色(或A中)布条不退色,湿润的有色(或B中)布条退色,结论:Cl2无漂白性,Cl2与水反应生成的HClO有漂白性;②Cl2 + H2O = H Cl+HClO,HClO为弱电解质,所以离子方程式为Cl2 + H2O = H+ + Cl-+HClO;③氯气有毒,所以C装置的作用是吸收氯气,防止环境污染;1mol氯气参加该反应转移1mol电子,所以0.1mol氯气参加该反应转移0.1mol电子;(2)实验目的是探究Cl2的氧化性。Cl2 + H2O = H+ + Cl-+HClO,溶液含有H+所以紫色石蕊变红色,HClO具有强氧化性,所以紫色石蕊褪色;Fe2+具有还原性,被氯气氧化为Fe3+,反应的方程式为2Fe2++Cl2===2Fe3++2Cl-;滴加氯化钡溶液,有白色沉淀生成,说明溶液中的SO32-被氧化为SO42-,反应的离子方程式为SO32-+Cl2=== SO42-+2Cl-。
考点:本题考查氯气的性质。


科目:高中化学 来源:2014-2015学年山西省高二10月月考化学试卷(解析版) 题型:填空题
在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)  2NH3(g)ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
2NH3(g)ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
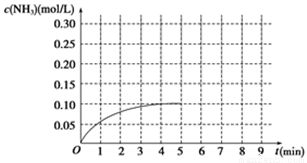
(1)根据图示,计算从反应开始到平衡时(4min末),平均反应速率v(NH3)为____________________;
(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为____________(填序号);
a.0.20 mol/L b.0.12 mol/L c.0.10 mol/L d.0.08 mol/L
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡______________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数________(填“增大”、“减小”或“不变”);
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在图中画出第5分钟末到达新平衡时NH3浓度的变化曲线。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西大学附中第一学期高二化学试卷(解析版) 题型:选择题
有两种短周期元素X和Y,可组成化合物XY3,当Y的原子序数为m时,X的原子序数为:①m-4;②m+4;③m+8;④m-2;⑤m+6。其中正确的组合是( )
A.①②④ B.①②⑤ C.①②③⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊三县市高二上学期联考化学试卷(解析版) 题型:选择题
已知反应Cu(s)+2Ag+(aq)===Cu2+(aq)+2Ag(s)为一自发进行的氧化还原反应,将其设计成如图所示原电池。下列说法中正确的是
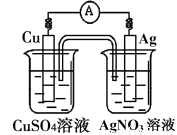
A.铜电极是正极,其电极反应为Cu-2e-=Cu2+
B.银电极上发生还原反应,电极质量增加
C.当铜电极质量减少0.64g时,电解质溶液中有0.02mol电子通过
D.外电路中电子由银电极流向铜电极
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊三县市高二上学期联考化学试卷(解析版) 题型:选择题
向水中分别加入下列溶液,对水的电离平衡不产生影响的是
A.KHSO4溶液 B.KHCO3溶液
C.KHS溶液 D.KI溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊三县市高一上学期联考化学试卷(解析版) 题型:选择题
已知常温下在溶液里可发生如下两个离子反应:
Ce4++Fe2+===Fe3++Ce3+
Sn2++2Fe3+===2Fe2++Sn4+
由此可以确定Fe3+、Ce4+、Sn4+三种离子的氧化性由强到弱的顺序
A.Sn4+、Fe3+、Ce4+ B.Ce4+、Fe3+、Sn4+
C.Sn4+、Ce4+、Fe3+ D.Fe3+、Sn4+、Ce4+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊三县市高一上学期联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.H2O2、Cl2都具有很强的氧化性,在反应中只能做氧化剂
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.14C可用于文物的年代鉴定,14C与12C中所含质子数不同
D.有单质参加或生成的反应一定属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省德州市普高高二上学期期中理科化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.NaCl溶液在电流的作用下电离为钠离子和氯离子
B.溶于水后能电离出氢离子的化合物都是酸
C.尽管BaSO4难溶于水,但它仍然是强电解质
D.二氧化碳溶于水后能部分电离,所以二氧化碳是弱电解质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东桓台第二中学高二上学期(10月)检测化学试卷(解析版) 题型:选择题
通常状况下,NC13是一种油状液体,其分子空间构型与氨分子相似,下列对NC13的有关叙述正确的是( )
A.分子中N—C1键键长比CCl4分子中C—C1键键长长
B.分子中的所有原于均达到8电子稳定结构
C.NCl3分子是非极性分子
D.NBr3比NCl3易挥发
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com