
在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)  2NH3(g)ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
2NH3(g)ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
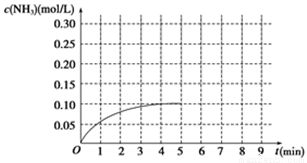
(1)根据图示,计算从反应开始到平衡时(4min末),平均反应速率v(NH3)为____________________;
(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为____________(填序号);
a.0.20 mol/L b.0.12 mol/L c.0.10 mol/L d.0.08 mol/L
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡______________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数________(填“增大”、“减小”或“不变”);
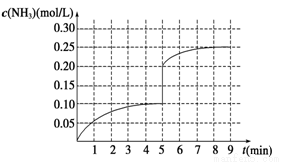
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在图中画出第5分钟末到达新平衡时NH3浓度的变化曲线。
(1)0.025 mol/(L·min) (2)ac (3)向正反应方向 不变
(4)
【解析】
试题分析:(1)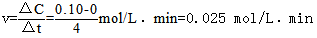 。(2)该反应是可逆反应,所以反应物不能完全转化为生成物,所以氨气的浓度不可能为0.20mol/L;Q>0,所以该反应是放热反应,升高温度,平衡向逆反应方向移动,降低温度,平衡向正反应方向移动,所以氨气的浓度不可能为0.10mol/L,故选ac。(3)该反应是气体体积减小的反应,把容器的体积缩小一半,增大了反应体系的压强,增大压强,平衡向气体体积减小的方向移动,即向正反应方向移动;化学平衡常数只与温度有关,温度不变,平衡常数不变。(4)把容器的体积缩小一半的瞬间氨气的浓度,氨气的浓度变为0.20mol/L,平衡后浓度约为0.25mol/L。
。(2)该反应是可逆反应,所以反应物不能完全转化为生成物,所以氨气的浓度不可能为0.20mol/L;Q>0,所以该反应是放热反应,升高温度,平衡向逆反应方向移动,降低温度,平衡向正反应方向移动,所以氨气的浓度不可能为0.10mol/L,故选ac。(3)该反应是气体体积减小的反应,把容器的体积缩小一半,增大了反应体系的压强,增大压强,平衡向气体体积减小的方向移动,即向正反应方向移动;化学平衡常数只与温度有关,温度不变,平衡常数不变。(4)把容器的体积缩小一半的瞬间氨气的浓度,氨气的浓度变为0.20mol/L,平衡后浓度约为0.25mol/L。
考点:考查了化学反应速率的定量表示方法、化学平衡常数、化学平衡的影响因素等知识点。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年广东省第一学期高一第一次月考化学试卷(解析版) 题型:选择题
下列各组混合物的分离或提纯方法正确的是( )
A.提纯NaCl和KNO3的混合物中的KNO3:加热蒸发、冷却结晶,过滤
B.除去CO2中混有的少量CO:混合气体依次通过NaOH溶液和浓硫酸
C.除去盐酸溶液中混有的少量CaCl2:加入过量CaCO3粉末,过滤
D.将自来水制成蒸馏水:蒸馏
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东东莞市高二上学期第一次月考化学试卷(解析版) 题型:选择题
在同温同压下,下列各组热化学方程式中b>a的是( )
A.H2(g)+Cl2(g)=2HCl(g);△H=-a 1/2H2(g)+1/2Cl2(g)=HCl(g);△H=-b
B. C(s)+1/2O2(g)=CO (g);△H=-a C(s)+O2(g)=CO2 (g);△H=-b
C.2H2(g)+O2(g)=2H2O(l);△H=-a 2H2(g)+O2(g)=2H2O(g);△H=-b
D.S(g)+O2(g)=SO2 (g);△H=-a S(s)+O2(g)=SO2 (g);△H=-b
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省高一上学期第一次考试化学试卷(解析版) 题型:选择题
某溶液中只含有K+ 、Na+ 、NO3- 、SO42-等四种离子,它们的物质的量之比为1∶6∶3∶2该溶液所含的溶质可能是( )
A、KNO3、Na2SO4 B、K2SO4、NaNO3、KNO3
C、KNO3 、Na2SO4、NaNO3 D、K2SO4、Na2SO4、KNO3、
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省高一上学期第一次考试化学试卷(解析版) 题型:选择题
在标准状况下,若两种气体所占体积不同,其原因是
A.气体性质不同 B.气体分子的大小不同
C.气体分子间平均距离不同 D.气体的物质的量不同
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省高二10月月考化学试卷(解析版) 题型:选择题
某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g) 2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则
2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则
A.平衡不移动
B.再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C.再达平衡时,C的体积分数增大
D.再达平衡时,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省高二10月月考化学试卷(解析版) 题型:选择题
一定条件下的反应:PCl5(g) PCl3(g)+Cl2(g) △H>0达到平衡后,下列情况使PCl5分解率降低的是
PCl3(g)+Cl2(g) △H>0达到平衡后,下列情况使PCl5分解率降低的是
A.温度、体积不变,充入氩气 B.体积不变,对体系加热
C.温度、体积不变,充入氯气 D.温度不变,增大容器体积
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西大学附中第一学期高二化学试卷(解析版) 题型:选择题
两种气态烃组成的混合物0.1 mol 完全燃烧得0.16 molCO2和3.6g水。下列说法的是
A.一定有甲烷 B.一定有甲烷和乙烯 C.一定有乙烷 D.一定有乙烯
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊三县市高一上学期联考化学试卷(解析版) 题型:填空题
(16分)氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。某化学兴趣小组同学对氯气的性质进行如下探究:
(1)兴趣小组同学按下图装置进行实验,探究Cl2的漂白性。
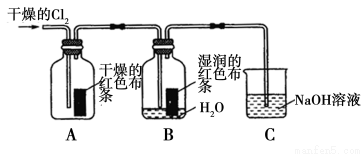
①通入Cl2后,观察到的现象是 根据现象可得出的结论是______。
②集气瓶B发生反应的离子方程式是______。
③C装置的作用是______,若有2.24 L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子数为________mol。
(2)兴趣小组同学按下图装置进行实验,探究Cl2的氧化性。
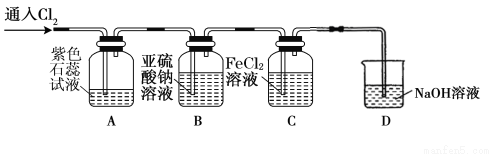
①实验开始后,观察装置A中的现象是: 。
②装置C中发生反应的离子方程式是 。
③停止通入氯气,取装置B中少量溶液于洁净的试管中,向其中滴加足量稀盐酸,再向其中滴加氯化钡溶液,有白色沉淀生成。则通入Cl2时装置B中发生反应的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com