
【题目】在一定条件下,N2和O2于密闭容器中发生如下反应:N2(g)+O2(g)2NO(g)(正反应是放热反应)下列说法正确的是( )
A. 在上述条件下,![]() 能完全转化为NO
能完全转化为NO
B. 升高温度可以提高这个反应的化学反应速率
C. 达到平衡时![]()
D. 加大压强可以加快这个反应的化学反应速率
科目:高中化学 来源: 题型:
【题目】金属及其化合物在生产生活等各个领域有着广泛的应用。
(1)钛具有良好的金属性能。钛基态原子中电子占据能级个数为______。与钛同周期的元素中,基态原子的未成对电子数与钛相同的还有______种。钛比钢轻、比铝硬,是一种新兴的结构材料,钛硬度比铝大的可能原因是________。
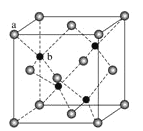
(2)有一种氮化钛晶体的晶胞与NaCl晶胞相似,该晶胞中N、Ti之间的最近距离为a×10-10cm,则该氮化钛的密度为_________g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。
(3)Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。Li2O是尚子晶体,其晶格能可通过图(a)的Bom-Haber循环计算得到。

Li原子的第一电离能为______kJ·mol-1,O==O键键能为______kJ·mol-1,Li2O晶格能为_______kJ·mol-1。
(4)Zn可形成多种化合物,其中立方ZnS晶胞结构如下图,其阴离子(S2-)按面心立方密堆积排布,立方ZnS的配位数与NaCl不同,这是由__________因素决定的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.足量的KI溶液与FeCl3溶液反应后,用CCl4萃取其中的I2,分液,在水溶液中滴加KSCN溶液仍呈血红色,说明该反应有一定的限度
B.在一定条件下,一份双氧水样品经过2h,H2O2的浓度从0.05molL-1下降到0.03molL-1,H2O2在这2h中分解的平均反应速率约为0.015molL-1h-1
C.其他条件相同时,升高温度,对于吸热反应,反应速率加快,对于放热反应,反应速率减慢
D.一定条件下,固定体积的密闭容器中发生反应A(g)+B(g)2C(g),当容器内A、B、C的浓度之比为1:1:2时,该反应处于平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,可以制备一系列物质(如图所示)。下列有关表述正确的是( )
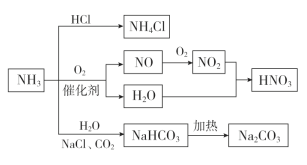
A.NH4Cl和NaHCO3都是常用的化肥
B.NH4Cl、HNO3和Na2CO3受热时都易分解
C.NH3和NO2在一定条件下可发生氧化还原反应
D.NH3与HCl反应属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列指定溶液中微粒的浓度关系正确的是( )
A. ![]() 溶液中:
溶液中:![]()
B. ![]() 溶液中:
溶液中:![]()
C. ![]() 弱酸
弱酸![]() 与
与![]() 溶液等体积混合的溶液中:
溶液等体积混合的溶液中: ![]()
D. ![]() 溶液与同浓度等体积盐酸混合的溶液中:
溶液与同浓度等体积盐酸混合的溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物。回答下列问题:
(1)写出基态Cu+的核外电子排布式:______;C、N、O三种元素的第一电离能由大到小的顺序是______
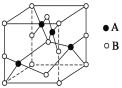
(2)如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为__________。
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水至沉淀刚好全部溶解时可得到蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀。该深蓝色沉淀中的NH3通过___键与中心离子Cu2+结合;NH3分子中N原子的杂化方式是____与NH3分子互为等电子体的一种微粒是________(任写一种)。
(4)CuO的熔点比CuCl的熔点________(填“高”或“低”)。
(5)CuO在高温下易转化为Cu2O,其原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,探究铜与稀HNO3的反应过程如图:
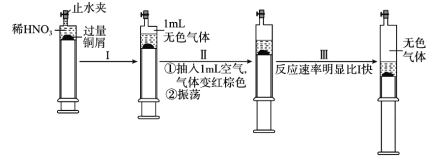
下列说法不正确的是( )
A.过程I中生成无色气体的离子方程式是3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
B.步骤III反应速率比I快的原因是NO2溶于水,使c(HNO3)增大
C.由实验可知,NO2对该反应具有催化作用
D.当活塞不再移动时,打开止水夹,滴加稀硫酸,铜可以继续溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com