
【题目】金属及其化合物在生产生活等各个领域有着广泛的应用。
(1)钛具有良好的金属性能。钛基态原子中电子占据能级个数为______。与钛同周期的元素中,基态原子的未成对电子数与钛相同的还有______种。钛比钢轻、比铝硬,是一种新兴的结构材料,钛硬度比铝大的可能原因是________。
(2)有一种氮化钛晶体的晶胞与NaCl晶胞相似,该晶胞中N、Ti之间的最近距离为a×10-10cm,则该氮化钛的密度为_________g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。
(3)Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。Li2O是尚子晶体,其晶格能可通过图(a)的Bom-Haber循环计算得到。

Li原子的第一电离能为______kJ·mol-1,O==O键键能为______kJ·mol-1,Li2O晶格能为_______kJ·mol-1。
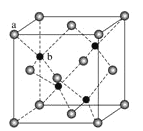
(4)Zn可形成多种化合物,其中立方ZnS晶胞结构如下图,其阴离子(S2-)按面心立方密堆积排布,立方ZnS的配位数与NaCl不同,这是由__________因素决定的。
【答案】7 3 钛原子的价电子数比A1多,金属键更强 ![]() 520 498 2908 离子半径和离子电荷数
520 498 2908 离子半径和离子电荷数
【解析】
(1) 钛原子核外有22个电子,根据核外电子排布规律写出钛原子的电子排布式,再确定电子占据能级个数;基态Ti原子的未成对电子数为2,据此分析;
(2) 根据均摊法,可知该晶胞中N和Ti原子个数,再根据![]() =
=![]() 计算;
计算;
(3) Li原子的第一电离能是指1mol气态锂原子失去1mol电子变成1mol气态锂离子所吸收的能量;O![]() O键键能是指1mol氧气分子断裂生成气态氧原子所吸收的能量;晶格能是指气态离子结合生成1mol离子晶体所释放的能量或1mol离子晶体断裂离子键形成气态离子所吸收的能量,以此解答。
O键键能是指1mol氧气分子断裂生成气态氧原子所吸收的能量;晶格能是指气态离子结合生成1mol离子晶体所释放的能量或1mol离子晶体断裂离子键形成气态离子所吸收的能量,以此解答。
(4)配位数不同,跟几何或半径或电荷有关。
(1) 钛原子核外有22个电子,基态钛原子电子排布式为1s22s22p63s23p63d24s2,则电子占据能级个数为7;基态原子的未成对电子数为2;第四周期中未成对电子数为2的元素有Ge、Se、Ni,有3种;钛原子的价电子数是4、铝原子的价电子数是3,钛原子的价电子数比铝多,金属键更强,所以钛的硬度比铝大;
故答案为:7;3;钛原子的价电子数比Al多,金属键更强;
(2) 根据均摊法,可知该晶胞中N原子个数为6![]() +8
+8![]() =4,Ti原子个数为1+12
=4,Ti原子个数为1+12![]() =4,所以晶胞的质量为m=
=4,所以晶胞的质量为m=![]() g,而晶胞的体积V=(2a×10-10)3cm3,所以晶胞的密度
g,而晶胞的体积V=(2a×10-10)3cm3,所以晶胞的密度![]() =
= ![]() g·cm-3;
g·cm-3;
(3) Li原子的第一电离能是指1mol气态锂原子失去1mol电子变成1mol气态锂离子所吸收的能量,即为![]() =520kJ·mol-1;O=O键键能是指1mol氧气分子断裂生成气态氧原子所吸收的能量,即为249kJ·mol-1
=520kJ·mol-1;O=O键键能是指1mol氧气分子断裂生成气态氧原子所吸收的能量,即为249kJ·mol-1![]() =498 kJ·mol-1。晶格能是指气态离子结合生成1mol离子晶体所释放的能量或1mol离子晶体断裂离子键形成气态离子所吸收的能量,则Li2O晶格能为2908kJ·mol-1。
=498 kJ·mol-1。晶格能是指气态离子结合生成1mol离子晶体所释放的能量或1mol离子晶体断裂离子键形成气态离子所吸收的能量,则Li2O晶格能为2908kJ·mol-1。
因此,本题正确答案是:520 ;498 ;2908。
(4)根据均摊法可知,阴离子(S2- )的配位数为8×![]() +6×
+6×![]() =4,阳离子(Zn2+)的配位数为4,则S2-的配位数也是4,立方ZnS的配位数与NaCl不同,这是由高子半径和离子所带的电荷数等因素共同决定的。
=4,阳离子(Zn2+)的配位数为4,则S2-的配位数也是4,立方ZnS的配位数与NaCl不同,这是由高子半径和离子所带的电荷数等因素共同决定的。


科目:高中化学 来源: 题型:
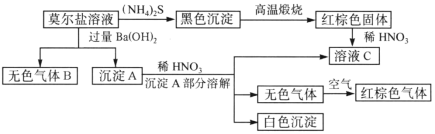
【题目】莫尔盐是硫酸盐的一种复盐,是一种重要的化学试剂,它的水溶液中加入KSCN不显红色,并有如图所示的反应:
根据以上关系,按要求填空:
(1)可用检验气体B__________________。
(2)莫尔盐的化学式为____________________。
(3)部分沉淀A与稀HNO3反应的离子方程式是_____________________。
(4)古代硫酸的制法是隔绝空气锻烧绿矾(FeSO4·7H2O),将蒸气冷却可制得一种无色粘稠的液体“绿矾油”,剩余的固体为红棕色。(已知SO3的熔点是16.8°C,沸点是44.8°C,再加矾受热分解的产物)

①装置的连接顺序为______________。
②B的作用是验证该反应有水生成,其中的试剂为_________,实验过程中发现F中溶液褪色,D中出现无色粘稠液体,则煅烧绿矾的反应方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种常见的单质,B、C为中学化学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去),下列判断正确的是
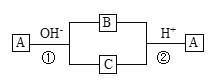
A.X元素可能为Al
B.X元素不一定为非金属元素
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图结构的说法不正确的是( )
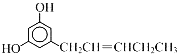
A. 分子中既有![]() 键又有π键
键又有π键
B. 碳原子有sp、sp2、sp3三种杂化方式
C. O—H键的极性强于C-H键的极性
D. 羟基中氧原子采取sp3杂化,VSEPR模型为四面体形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取三份浓度均为0.1 mol/L,体积均为1 L 的CH3COONa 溶液中分别加入NH4Cl 固体、CH3COONH4固体、HCl 气体后所得溶液pH 变化曲线如图(溶液体积变化忽略不计)下列说法不正确的是
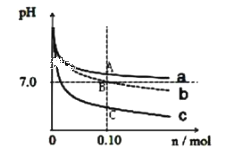
A.曲线 a、b、c 分别代表加入 CH3COONH4、NH4Cl、HCl
B.由图可知 Ka(CH3COOH)=Kb(NH3﹒H2O)=1×10-7
C.A点处 c(CH3COO-)>c(Na+)> c(NH4+)> c(OH-)> c(H+)
D.C点处 c(CH3COO-)+c(Cl-)+c(OH-)>0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取代反应是有机化学中一类重要的反应,下列反应不属于取代反应的是
A. CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
B. ![]() +Br2
+Br2![]() +HBr
+HBr
C. 2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
D. CH3CH2Br+NaOH![]() CH3CH2OH+NaBr
CH3CH2OH+NaBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 NA是阿伏加德罗常数的值,下列说法正确的是
A.32gS8与 S6(![]() )的混合物中所含共价键数目为NA
)的混合物中所含共价键数目为NA
B.1L0.1mol L-1H2C2O4溶液中含 C2O42- 离子数为0.1NA
C.2molNO与 2molO2在密闭容器中充分反应,转移的电子数为 8NA
D.标准状况下 22.4L氯气与甲烷的混合气体,光照时充分反应生成 HCl分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是:___(填具体元素符号或化学式,下同)。⑥元素的原子结构示意图是___。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是__,碱性最强的化合物的化学式是___。
(3)最高价氧化物是两性氧化物的元素是_;写出它最高价氧化物对应水化物与氢氧化钠反应的化学方程式__。
(4)元素③与④形成淡黄色化合物的电子式:___,该化合物属于___(填“共价”或“离子”)化合物。
(5)用电子式表示③与①最高价态形成的化合物的形成过程___,将标准状况下4.48L该化合物通入足量的③和④形成的淡黄色固体化合物中,充分反应后,固体的质量增加___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,N2和O2于密闭容器中发生如下反应:N2(g)+O2(g)2NO(g)(正反应是放热反应)下列说法正确的是( )
A. 在上述条件下,![]() 能完全转化为NO
能完全转化为NO
B. 升高温度可以提高这个反应的化学反应速率
C. 达到平衡时![]()
D. 加大压强可以加快这个反应的化学反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com