
已知NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO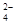 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( )
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( )
A.该温度高于25 ℃
B.由水电离出来的H+的浓度是1.0×10-10 mol·L-1
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
D
【解析】
试题分析:pH=6的蒸馏水,说明蒸馏水中氢离子的浓度是1.0×10-6mol·L-1,所以水的离子积常数是1.0×10-12,这说明水的电离是被促进的,因此温度高于25℃,A正确;B中溶液中氢离子浓度是0.01mol/L,则溶液中OH-的浓度就是1.0×10-10 mol·L-1,则由水电离出来的H+的浓度是1.0×10-10 mol·L-1,B正确;硫酸氢钠能电离出氢离子,抑制水的电离,C正确;D中氢氧化钠的浓度是1mol/L,所以反应后氢氧化钠是过量的,溶液显碱性,D不正确,答案选D。
考点:考查外界条件对水的电离平衡的影响、离子浓度计算以及溶液酸碱性的判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,贴近高考,有利于考查学生的逻辑推理能力和灵活应变能力。该题的关键是明确该温度下水的离子积常数的变化,然后再结合题意灵活分析即可得出正确的结论。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 电离常数 |
| HClO | Ka=3×10-8 |
| H2CO3 | Ka1=4.3×10-7 |
| Ka2=5.6×10-11 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该温度高于25℃ | B、由水电离出来的H+ 的浓度是1.0×10-10mol?L-1 | C、该温度下加入等体积pH=12 的NaOH 溶液可使该溶液恰好呈中性 | D、NaHSO4晶体的加入抑制了水的电离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com