
����Ŀ��ijС��ͬѧ���������������������ȷ�Ӧ��õ��Ĺ����������ʵ�飮
��1��������������Ӧ�Ļ�ѧ����ʽ�� ��
��2������ɷֵij���ȷ����
ʵ����� | ���������� |
�� | ȡ����������Ʒ���������ϡ���ᣬ�����ܽ⣬������ɫ���壨������ΪH2������Һ��dz��ɫ |
�� | ����������Һ�м�������KSCN��Һ����Һ��dz��ɫ���ټ���H2O2��Һ��������������ɫ���壨������ΪO2������Һ��Ϊ���ɫ���Һ�ɫ�ܿ���ȥ |
��������ʵ���֪����Һ��FeԪ�صĴ�����ʽ��
�ڢ��в���H2��ԭ������Ʒ�г���Fe�⣬������δ��Ӧ��Al��Ϊ������Ʒ���Ƿ�Al���ʣ���������ʵ�飬���ݵ�ԭ���ǣ������ӷ���ʽ��ʾ��
������O2�Ļ�ѧ����ʽ��
��һ����ʵ�����������������Ʒ��FeԪ�صĴ�����ʽ�У�Fe��Fe2O3��Fe3O4 ��
��3����С��ͬѧ�Ԣ�����Һ��ɫ��ȥ��ԭ������һ��̽����
ʵ����� | ���������� |
�� | ������ʣ����Һ����Ϊ���ݣ�һ�ݵμ�NaOH��Һ���������ɫ������ |
�� | ȡ2mL 0.1mol/L FeCl3��Һ������KSCN��Һ����Һ��Ϊ��ɫ��ͨ��һ��ʱ��O2 �� |
��ʾ��KSCN��SԪ�صĻ��ϼ�Ϊ��2��
��ʵ�颣�а�ɫ�����Ļ�ѧʽ��
�ڽ��ʵ�颣�͢�������ʵ�颢�к�ɫ��ȥ��ԭ����
�۲������ϵ�֪��Cl������Һ��ɫ��ȥ�ķ�Ӧ�д����ã���֤��˵��Ӧ�����ʵ��������� ��
���𰸡�
��1��2Al+Fe2O3 ![]() Al2O3+2Fe
Al2O3+2Fe
��2��Fe2+��Fe3+��2Al+2NaOH+2H2O=2NaAlO2+3H2����2H2O2 ![]() 2H2O+O2��
2H2O+O2��
��3��BaSO4����Һ��SCN�����ӱ�H2O2��������Һ��ɫ��ȥ���ֱ�ȡ2mL0.1mol/LFeCl3��Һ��2mL 0.05mol/L Fe2��SO4��3��Һ���ֱ����KSCN��Һ����Һ����Ϊ��ɫ���ٷֱ�����Ũ�ȵ������H2O2��Һ��FeCl3��Һ��ɫ�죨��ȡ0.05mol/L Fe2��SO4��3��Һ������KSCN��Һ����Һ���ɫ������ɫ��Һ��Ϊ2�ݣ�1�ݼ���NaCl���壬��һ�ݲ��䣬����������Һ�о������Ũ�ȵ������H2O2��Һ������NaCl����Һ��ɫѸ����ɫ��
���������⣺��1��Al���������ڸ����·������ȷ�Ӧ������������������Ӧ�Ļ�ѧ����ʽΪ��2Al+Fe2O3 ![]() Al2O3+2Fe�����Դ��ǣ�2Al+Fe2O3
Al2O3+2Fe�����Դ��ǣ�2Al+Fe2O3 ![]() Al2O3+2Fe����2��������������Һ�м�������KSCN��Һ����Һ��dz��ɫ��˵����Һ�к���Fe3+ �� �ټ���H2O2��Һ��������������ɫ���壨������ΪO2������Һ��Ϊ���ɫ��˵����Һ����˫��ˮ����Һ��������Ũ��������ԭ��Һ�к���Fe2+ ��
Al2O3+2Fe����2��������������Һ�м�������KSCN��Һ����Һ��dz��ɫ��˵����Һ�к���Fe3+ �� �ټ���H2O2��Һ��������������ɫ���壨������ΪO2������Һ��Ϊ���ɫ��˵����Һ����˫��ˮ����Һ��������Ũ��������ԭ��Һ�к���Fe2+ ��
���Դ��ǣ�Fe2+��Fe3+���ڽ������ܹ�������������Һ��Ӧ����ƫ�����ƺ���������Ӧ�Ļ�ѧ����ʽΪ��2Al+2NaOH+2H2O=2NaAlO2+3H2������д�����ӷ���ʽΪ��2Al+2OH��+2H2O=2AlO2��+3H2����������������������Һ��Ӧ���ݴ˿��Լ����Ƿ���Al��
���Դ��ǣ�2Al+2NaOH+2H2O=2NaAlO2+3H2������˫��ˮ�������������������·ֽ�����ˮ����������Ӧ�Ļ�ѧ����ʽΪ��2H2O2 ![]() 2H2O+O2����
2H2O+O2����
���Դ��ǣ�2H2O2 ![]() 2H2O+O2������3��ʵ�颢����Һ��ɫ��ȥ��ԭ���Ȼ��Fe3+��SCN�����������£�ʵ�颣������֤ʵ�颢ʣ�����Һ�д��������ӣ�Ȼ��֤����Һ�д�����������ӣ��Ӷ�֤��SCN����������ʵ�颤֤������SCN������˫��ˮ���������������ټ����Ȼ�����Һ�����ɲ���������İ�ɫ����ΪBaSO4 ��
2H2O+O2������3��ʵ�颢����Һ��ɫ��ȥ��ԭ���Ȼ��Fe3+��SCN�����������£�ʵ�颣������֤ʵ�颢ʣ�����Һ�д��������ӣ�Ȼ��֤����Һ�д�����������ӣ��Ӷ�֤��SCN����������ʵ�颤֤������SCN������˫��ˮ���������������ټ����Ȼ�����Һ�����ɲ���������İ�ɫ����ΪBaSO4 ��
���Դ��ǣ�BaSO4������Һ�д���ƽ�⣺Fe3++3SCN��Fe��SCN��3 �� ����˫��ˮ��SCN����������SCN����Ũ�ȼ�С��ƽ�����������ƶ���������Һ��ɫ��ȥ��
���Դ��ǣ���Һ��SCN�����ӱ�H2O2��������Һ��ɫ��ȥ���۽�ʵ�颤��2mL 0.1mol/L FeCl3��Һ��Ϊ2mL 0.05mol/L Fe2��SO4��3��Һ���ظ���ʵ�飬����Ϊ������˫��ˮ��Һ��ɫ��һ��ʱ����ȥ��������ȥ���������������������Ϊ���ֱ�ȡ2mL 0.1mol/L FeCl3��Һ��2mL 0.05mol/L Fe2��SO4��3��Һ���ֱ����KSCN��Һ����Һ����Ϊ��ɫ���ٷֱ�����Ũ�ȵ������H2O2��Һ��FeCl3��Һ��ɫ�죨��ȡ0.05mol/L Fe2��SO4��3��Һ������KSCN��Һ����Һ���ɫ������ɫ��Һ��Ϊ2�ݣ�1�ݼ���NaCl���壬��һ�ݲ��䣬����������Һ�о������Ũ�ȵ������H2O2��Һ������NaCl����Һ��ɫѸ����ɫ����
���Դ��ǣ��ֱ�ȡ2mL0.1mol/LFeCl3��Һ��2mL 0.05mol/L Fe2��SO4��3��Һ���ֱ����KSCN��Һ����Һ����Ϊ��ɫ���ٷֱ�����Ũ�ȵ������H2O2��Һ��FeCl3��Һ��ɫ�죨��ȡ0.05mol/L Fe2��SO4��3��Һ������KSCN��Һ����Һ���ɫ������ɫ��Һ��Ϊ2�ݣ�1�ݼ���NaCl���壬��һ�ݲ��䣬����������Һ�о������Ũ�ȵ������H2O2��Һ������NaCl����Һ��ɫѸ����ɫ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��� ![]() Cl��
Cl�� ![]() Cl˵����ȷ���ǣ�������
Cl˵����ȷ���ǣ�������
A.������ͬ��������
B.������ͬ��������
C.������ͬ��������
D.���Dz���Ϊͬλ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����̬������һ����̬ϩ���Ļ����9g�����ܶ�����ͬ�����������ܶȵ�11.25�������������ͨ��������ˮʱ����ˮ����4.2g������������̬����(����)
A.�������ϩ
B.�������ϩ
C.����ͱ�ϩ
D.����Ͷ�ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��100mL 2.0 molL��1 ��̼������Һ��200mL���ᣬ���ܽ�ǰ�ߵμ�����ߣ����ǽ����ߵμ���ǰ�ߣ����ն�����������������ɵ����������ͬ������ѡ���������Ũ�Ⱥ������ǣ�������
A.2.0 molL��1
B.1.5 molL��1
C.1 molL��1
D.0.5 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����(����)
A. ������������ȼ������Al2O3������˿��������ȼ������Fe2O3
B. ���ܴ�����ͭ��Һ���û���ͭ������Ҳ�ܴ�����ͭ��Һ���û���ͭ
C. ���ý����Ʊ�����ú���У��ʻ��ý�����Ҳ������ú����
D. ����������ˮ�ȷ�Ӧʱ�ƾ�����ԭ�����ʽ������ʲ��뷴Ӧʱ����������ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йط�Ӧԭ���뻯ѧ��Ӧ����ʽ������ǣ�������
A.������������������ȼ�գ�Fe+Cl2 ![]() FeCl2
FeCl2
B.�������ڿ�����ȼ�գ�4Na+O2 ![]() 2Na2O
2Na2O
C.��¯�����У���ԭ����ʯ��2Fe2O3+3C ![]() 4Fe+3CO2
4Fe+3CO2
D.����þ�Ż𣬲�����CO2���2Mg+CO2 ![]() 2MgO+C
2MgO+C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���ǣ�������
A.���۷���ϡ������Һ��2Fe+6H+�T2Fe3++3H2��
B.��NH4HCO3��Һ�мӹ�����NaOH��Һ�����ȣ�NH4++OH�� ![]() NH3��+H2O
NH3��+H2O
C.ʯ��ʯ��ϡ���ᷴӦ��CO32��+2H+�TCO2��+H2O
D.Cl2ͨ��ˮ�У�Cl2+H2OH++Cl��+HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������HA��������NaA�Ļ����Һ���ڻ�ѧ������������Һ�������м�����������ʱ����Һ������Ա仯����
��1�������Һ�м�����������ʱ��������Ӧ�����ӷ���ʽ�� �� �����м�������KOH��Һʱ��������Ӧ�����ӷ���ʽ����
��2���ֽ�0.04molL��1HA��Һ��0.02molL��1NaOH��Һ�������ϣ��õ�������Һ��
����HAΪHCN������Һ�Լ��ԣ�����Һ��c��Na+��c��CN���������������=������������ó��ý��۵����������û����Һ�������غ�ʽ�� ��
����HAΪCH3COOH������Һ�����ԣ���Һ�����е����Ӱ�Ũ���ɴ�С���е�˳���� �� �û����Һ�������غ�ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ԭ���װ�ã�X��YΪ�����缫���������ҺΪϡ���ᣬ���·�еĵ���������ͼ��ʾ���Դ�װ�õ�����������ȷ���ǣ� �� 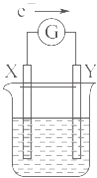
A.���·�еĵ�������Ϊ��X�����·��Y
B.�������缫�ֱ�ΪZn��̼������XΪ̼����YΪZn
C.�������缫���ǽ����������ǵĻ��ΪX��Y
D.X���Ϸ������ǻ�ԭ��Ӧ��Y���Ϸ�������������Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com