
| 实验操作 | 预期现象和结论 |
| 取少量反应后固体于试管中, 。 | |
| 实 验 操 作 | 预 期 现 象 与 结 论 |
| 取少量反应后固体于试管中,向试管中加入少量水,将湿润的红色石蕊试纸置于试管口; 另取少量反应后固体于试管中,向试管中加入少量水,将产生气体通入淀粉—KI溶液中; (2分) | 若红色石蕊试纸显蓝色,且淀粉—KI溶液不变色 则假设1成立; 若 红色石蕊试纸不显蓝色,且淀粉—KI溶液变蓝色, 则假设2成立; 若红色石蕊试纸显蓝色,且淀粉—KI溶液变蓝色,则假设3成立;(3分) |


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.MgCO3、MgO、Mg3N2 | B.Mg(OH)2、MgO、MgCO3 |
| C.MgO、Mg3N2、C | D.Mg2N3、C、MgO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
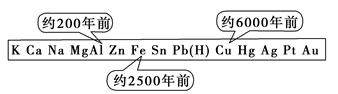
| A.金属的化合价高低 | B.金属的活动性大小 |
| C.金属的导电性强弱 | D.金属在地壳中的含量多少 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.金属;C |
| B.陶瓷;SiO2 |
| C.合成树脂;SiO2、Al2O3、MgO |
| D.合成树脂;C |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 氢氧化物 | Ti(OH)4 | Ti(OH)3 | Fe(OH)3 | Fe(OH)2 |
| pH | 0.5 | 3.0 | 1.5 | 7.6 |

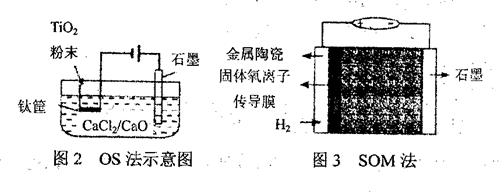
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com