
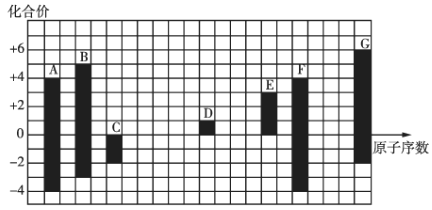
【题目】如图是部分短周期元素的常见化合价与原子序数的关系:
(1)元素![]() 在元素周期表中的位置是__________________。
在元素周期表中的位置是__________________。
(2)其中金属性最强的元素是______(用元素符号表示,下同),非金属性最强的元素是______。
(3)![]() 、
、![]() 、
、![]() 的半径由大到小的顺序是__________(用离子符号表示)。
的半径由大到小的顺序是__________(用离子符号表示)。
(4)最简单氢化物的稳定性:![]() ______
______![]() (填“
(填“![]() ”或“
”或“![]() ”)。
”)。
(5)![]() 、
、![]() 、
、![]() 元素最高价氧化物对应水化物的酸性:_____(用化学式表示,下同)
元素最高价氧化物对应水化物的酸性:_____(用化学式表示,下同)![]() ______
______![]() ______。
______。
(6)![]() 与
与![]() 形成的具有强氧化性的化合物为______(填化学式),该化合物与
形成的具有强氧化性的化合物为______(填化学式),该化合物与![]() 反应的化学方程式为________________________,其中氧化剂与还原剂的物质的量之比为____________。
反应的化学方程式为________________________,其中氧化剂与还原剂的物质的量之比为____________。
【答案】第2周期第ⅣA族 ![]()
![]()
![]() <
< ![]()
![]()
![]()
![]()

![]()
【解析】
由图中化合价可知,A、F的化合价都为+4、-4价,二者同主族,且F的原子序数较大,故A为碳元素、故F为Si元素;C的化合价为-2价,没有正化合价,故C为O元素;D的化合价为+1价,处于ⅠA族,原子序数大于O元素,故D为Na元素;E为+3价,为Al元素;G的最高正价为+6价、最低价为-2,应为S元素;B的有+5、-3价,处于ⅤA族,原子序数介于C、O之间,则B为N元素。
(1)A为碳元素,原子有2个电子层,最外层电子数为4,处于周期表中第二周期ⅣA族;
(2)金属性最强的元素为Na,非金属性最强的为O;
(3)电子层教越多,离子半径越大;电子层结构相同的离子,核电荷数越小,离子半径越大,故离子半径:![]() 。
。
(4)元素的非金属性:![]() ,则最简单氢化物的稳定性:
,则最简单氢化物的稳定性:![]() 。
。
(5)由于元素的非金属性:![]() ,则最高价氧化物对应水化物的酸性:
,则最高价氧化物对应水化物的酸性:![]() 。
。
(6)![]() 和
和![]() 元素形成的具有强氧化性的化合物是
元素形成的具有强氧化性的化合物是![]() ,
,![]() 是
是![]() ,二者发生反应的化学方程式为
,二者发生反应的化学方程式为![]() ,其中
,其中![]() 既是氧化剂又是还原剂,氧化剂与还原剂的物质的量之比为
既是氧化剂又是还原剂,氧化剂与还原剂的物质的量之比为![]() 。
。


科目:高中化学 来源: 题型:
【题目】以镍矿粉(主要成分为NiS,杂质FeS、CuS和SiO2等)为原料可制备NiCO3
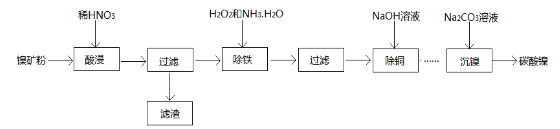
已知Ni和Fe为变价金属,常见化合价为+2价、+3价。
(1)在酸浸过程中,CuS与稀HNO3反应生成淡黄色固体,其离子方程式为___________________,滤渣的主要成分为________________________;
(2)在除FeS时,需加入过量的H2O2氧化,若用过强的氧化剂,其可能的后果是_______________;反应完全后,除去多余H2O2的简便方法是______________________;
(3)在“沉镍”工艺中,若将含Ni2+溶液缓慢加入至盛有Na2CO3溶液的反应容器中,可能会形成杂质,其原因是_______________________(用离子方程式表示)。检验碳酸镍沉淀完全的方法是__________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(![]() ),杏仁含苯甲醛(
),杏仁含苯甲醛(![]() )。下列说法错误的是( )
)。下列说法错误的是( )
A.可用溴水来检验肉桂醛分子中的碳碳双键
B.肉桂醛和苯甲醛能发生加成反应、取代反应和氧化反应
C.与肉桂醛官能团相同的芳香族同分异构体中能发生银镜反应的有4种
D.肉桂醛分子中所有碳原子可能位于同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1mol/L①CH3COOH、②NaOH、③CH3COONa,下列叙述正确的是( )
A.①中[CH3COOH]>[CH3COO-]>[H+]>[OH-]
B.①②等体积混合后,醋酸根离子浓度小于③的二分之一
C.①③等体积混合以后,溶液呈酸性,则(Na+)>(CH3COO-)>(H+)
D.①②等体积混合以后,水的电离程度比①③等体积混合的电离程度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.制取环氧乙烷:CH2=CH2+Cl2+Ca(OH)2→![]() +CaCl2+H2O,原子利用率为53.8%
+CaCl2+H2O,原子利用率为53.8%
B.煤在气化过程中脱硫可以减少污染
C.食品添加剂加入到食品中目的是防腐、保鲜等
D.锂电池应用广泛的主要原因是比能量高、可储存时间长
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z、W,原子序数依次增大,请结合表中信息回答下列问题。
字母代号 | X | Y | Z | W |
结构或性质 | X的最高价氧化物对应的水化物与其气态氢化物反应可得到一种盐 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,Z的离子半径最小 | 原子核外最外层电子数是次外层电子数的一半 |
(1)W在元素周期表中的位置为_________。
(2)四种元素的最高价氧化物对应的水化物中,有一种物质与其他三种物质在一定条件下均能发生化学反应,该元素是_____(填元素名称)。
(3)X元素的最高价氧化物对应的水化物与其气态氢化物反应得到的化合物为____(填化学式)。
(4)向含有Z元素的简单阳离子的溶液中加入过量的NaOH溶液,发生反应的离子方程式为______________。
(5)下列可用来判断Z和Mg的金属性强弱的方法是_____(填序号)。
a.测量两种元素单质的硬度和熔、沸点
b.比较单质与同浓度盐酸反应的剧烈程度
c.比较两种元素在化合物中化合价的高低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于新制氯水及久置氯水的说法中不正确的是( )
A.新制的氯水呈黄绿色,久置的氯水变为无色
B.新制的氯水漂白作用强,久置的氯水漂白作用很弱
C.新制的氯水所含微粒种类多,久置的氯水所含微粒种类较少
D.新制的氯水中无氯离子,久置的氯水中含有氯离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应C(s) + CO2(g)![]() 2CO(g) △H>0,达到平衡状态,进行如下操作:
2CO(g) △H>0,达到平衡状态,进行如下操作:
①升高反应体系的温度; ②增加反应物C的用量;
③缩小反应体系的体积; ④减少体系中CO的量。
上述措施中一定能使反应的正反应速率显著加快的是
A.①②③④B.①③C.①②D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2SO2(g)+O2(g)![]() 2SO3(g)△H=-QJ/mol(Q>0)。下列说法不正确的是( )
2SO3(g)△H=-QJ/mol(Q>0)。下列说法不正确的是( )
A.生成2molSO3,需要lmolO2参加反应
B.将2molSO2(g)和1molO2(g)充入一密闭容器中反应,放出QkJ的热量
C.加入催化剂,增大了活化分子百分数,加快了反应速率,降低了生产成本
D.2molSO2(g)和1molO2(g)的能量之和高于2molSO3(g)的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com