
 已知反应X(g)+Y(g)═nZ(g)△H>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示.下列说法不正确的是( )
已知反应X(g)+Y(g)═nZ(g)△H>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示.下列说法不正确的是( )| A. | 反应方程式中n=1 | |
| B. | 10min时,曲线发生变化的原因是升高温度 | |
| C. | 10min时,曲线发生变化的原因是增大压强 | |
| D. | 该反应的△S<0 |
分析 A.10min时反应物和生成物浓度瞬间同时增大,说明是增大了压强,反应物浓度逐渐减小,生成物浓度增加,平衡正向移动,则说明该反应是体积缩小的反应,即n=1,据此判断;
B.根据图象数据可知,10min时反应物和生成物浓度瞬间同时增大,则说明10min时增大了压强,据此判断;
C.根据图象数据可知,10min时反应物和生成物浓度瞬间同时增大,则说明10min时增大了压强,据此判断;
D.达到平衡时,增大压强后反应物浓度逐渐减小,生成物浓度增加,说明该反应是体积缩小的反应,即n=1,该反应是熵变减小的反应.
解答 解:A.10min时反应物和生成物浓度瞬间同时增大,说明是增大了压强,反应物浓度逐渐减小,生成物浓度增加,平衡正向移动,则说明该反应是体积缩小的反应,即n=1,故A正确;
B.根据图象数据可知,10min时反应物和生成物浓度瞬间同时增大,则说明10min时增大了压强,故B错误;
C.根据图象数据可知,10min时反应物和生成物浓度瞬间同时增大,则说明10min时增大了压强,故C正确;
D.由于10min时增大压强后,在重新达到平衡状态过程中,反应物浓度逐渐减小,生成物浓度逐渐增加,说明平衡向着正向移动,根据增大压强,平衡向着体积缩小的方向移动,所以该反应是体积缩小的反应,应该满足n<1+1,则n=1,该反应是混乱度减小的反应,即△S<0,故D正确;
故选B.
点评 本题考查了化学平衡的影响因素、物质的量随时间变化的曲线、化学反应速率的计算,题目难度中等,注意明确影响化学反应速率的因素,能够正确分析物质的量随时间变化的曲线是解题关键,还要明确化学反应速率的概念及计算方法.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LCCl4中含有分子的数目为0.5NA | |
| B. | 标准状况下,2.24LCl2通入水中生成NA个HClO | |
| C. | 1.6gO2与O3组成的混合物中所含O原子数为0.1NA | |
| D. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol MgCl2 | B. | 2mol KClO3 | C. | 1 mol AlCl3 | D. | 1.5 mol CaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的硫酸铵溶液中:c(SO42->c(NH4+)>c(H+)>c(OH-) | |
| B. | 0.1 mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | 1.0×l0-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 | |
| D. | 常温下,1mLpH=1的盐酸与l00mL pH=11的NaOH溶液混合后,溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 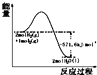 表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ/mol | |
| B. |  由图得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右 | |
| C. |  表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a | |
| D. |  表示常温下向体积为10 mL 0.1 mol/LNaOH溶液中逐滴加入0.1 mol/L CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-) 表示常温下向体积为10 mL 0.1 mol/LNaOH溶液中逐滴加入0.1 mol/L CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com