
| A、NaOH |
| B、H2SO4 |
| C、BaCl2 |
| D、AgNO3 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、滴定后酸式滴定管尖嘴处悬有一滴液体 |
| B、酸式滴定管洗净后,没有用标准盐酸润洗,直接装标准盐酸滴定碱液 |
| C、滴定前,酸式滴定管有气泡,滴定后消失 |
| D、记录所用盐酸体积时,先仰视读数,终点时俯视 |
查看答案和解析>>
科目:高中化学 来源: 题型:
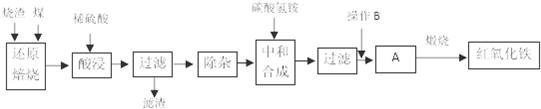
查看答案和解析>>
科目:高中化学 来源: 题型:
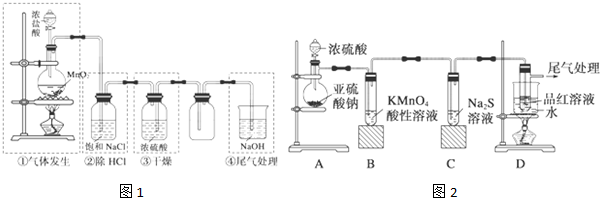
查看答案和解析>>
科目:高中化学 来源: 题型:
| 需鉴别物质 | 所加试剂或方法 | ||
| 方法1 | 方法2 | ||
| A | 木炭粉和氧化铜 | 观察颜色 | 通CO并加热 |
| B | NaCl溶液和Na2CO3溶液 | 稀HCl | Zn |
| C | NH4HCO3氮肥和K2SO4钾肥 | 加NaOH研磨并闻气味 | 稀H2SO4 |
| D | 稀HCl和KCl溶液 | Fe2O3 | 无色酚酞 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用渗析的方法精制Fe(OH)3胶体 |
| B、用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 |
| C、用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| D、用加热蒸发结晶的方法从AlCl3溶液得到AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A、保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 | ||
| B、保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol | ||
C、反应在t1min内的平均速率为v(H2)=
| ||
| D、温度升至800℃,上述反应平衡常数为0.64,则正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
x- 3 |
| A、+4 | B、+5 | C、+6 | D、+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
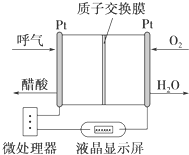 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )| A、电流由O2所在的铂电极经外电路流向另一电极 |
| B、O2所在的铂电极处发生还原反应 |
| C、该电池的负极反应式为:CH3CH2OH+3H2O-12e-═2CO2↑+12H+ |
| D、微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com