


科目:高中化学 来源: 题型:单选题
 Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高 或最低温度 |
| ① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10ml水 | 20℃ | 24.2℃ |
| ⑤ | 35mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
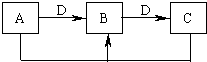
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
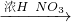 Cu(NO3)2
Cu(NO3)2 Cu(NO3)2
Cu(NO3)2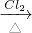 CuCl2
CuCl2 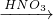 Cu(NO3)2
Cu(NO3)2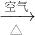 CuO
CuO 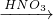 Cu(NO3)2
Cu(NO3)2查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com