
����Ŀ����Ũ����ȡ������Ϊ50ml��A��B��������������Һ�зֱ�ͨ��һ�����Ķ�����̼����ϡ����100ml��
��1��������������Һ��ͨ��һ�����Ķ�����̼����Һ�����ʵĿ�������У���______����_______��
��_______����_______��
��2����ϡ�ͺ����Һ����μ���0.1mol/L��������Һ������������̼�����(��״��)������������Һ�������ϵ��ͼ��ʾ��
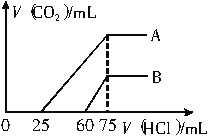
��A���߱�������ԭ��Һ��ͨ�������̼������������HCl��Ӧ����������̼����������_______mL(��״��)��
��B���߱�������ԭ��Һ��ͨ�������̼��������Һ�����ʵĻ�ѧʽΪ___________��
��ԭ����������Һ��NaOH�����ʵ���Ũ��Ϊ__________��
���𰸡�(10��)��1����NaOH��Na2CO3����Na2CO3����Na2CO3��NaHCO3����NaHCO3(4��)
��2����112(2��)��NaOH��Na2CO3(2��)��0.15mol/L(2��)
��������
�����������1����CO2+2NaOH�TNa2CO3+H2O��CO2+NaOH�TNaHCO3��������̼����ʱ����Ϊ��Na2CO3��NaOH����1��2ǡ�÷�ӦʱΪ��Na2CO3�����ʵ����Ƚ���1��1��1��2֮��Ϊ��Na2CO3��NaHCO3��������̼����ʱΪ��NaHCO3��
��2����ͼ��֪����ӦB��Һ��˵���μ�����60mLʱû���������ɣ����ܷ���OH-+H+=H2O��CO32-+H+=HCO3-������ԭ��Һ��ֻ��̼���ƣ�����̼��������Ҫ����������̼�����������Ȼ�����Ҫ����������ȣ�ʵ������Ҫ��������60mLԶԶ����̼�����������Ȼ�����Ҫ��������(75-60)mL=15mL��˵��ԭ��Һ�е�������NaOH��Na2CO3������A��Һ��˵���μ�����25mLʱû���������ɣ����ܷ���OH-+H+=H2O��CO32-+H+=HCO3-������ԭ��Һ��ֻ��̼���ƣ�����̼��������Ҫ����������̼�����������Ȼ�����Ҫ����������ȣ�ʵ������Ҫ��������25mLС��̼�����������Ȼ�����Ҫ��������(75-25)mL=50mL��˵��ԭ��Һ�е�������Na2CO3��NaHCO3��
������A��Һ��˵���μ�����25mLʱ���������ɣ���μ���0.1molL-1 �����ᣬ������CO2����ʱ��������ӦHCO3-+H+=H2O+CO2����
��HCO3-+H+=H2O+CO2��
1 1
n(CO2)=0.05L��0.1mol/L=0.005mol����������Ϊ0.005mol��22.4L/mol=0.112L=112mL��
��������������֪��B��������Na2CO3��NaOH������������Ĺ�ϵ��֪�����ʵ�����Ϊ3��1��
��������������������Һ�о�ֻ����NaCl��n(HCl)=n(NaOH)=0.075L��0.1mol/L=0.0075mol��c(NaOH)=n/V=0.0075mol��0.05L=0.15mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵��������ǣ� ��
A. �������������Ũ���ᷢ��ȡ����Ӧ
B. ��ϩ������������ʳƷ��װ���ϵ�ԭ��
C. �Ҵ���������ˮ�е��ܽ�ȴ���������
D. ����ͼ��������Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ���������������п��淴Ӧ����
A��3A��g��+B��g��![]() 2C��g������H<0
2C��g������H<0
B��A��g��+3B��s��+2C��g��![]() 3D��g������H<0
3D��g������H<0
C��C��s��+D��g��![]() A��g��+B��g����H>0
A��g��+B��g����H>0
D��2C��g��![]() 2A��g��+B��g����H>0
2A��g��+B��g����H>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֱ�������������ͨ��ϡNa2S��Һ�У�����ʹ��Һ����ǵ���
A��CO B��SO2 C��HCl D��CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������������ȷ����( )
A������NA����ԭ�ӵĺ��������ʵ���Ϊ2Ħ��
B��2Ħ��ˮ��Ħ��������1Ħ��ˮ��Ħ��������2��
C��25 ����1.01��105Pa, 64g��SO2�к��е�ԭ����Ϊ3NA
D��lĦ���κ����������ķ�������ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڽ�����˵���в���ȷ����(����)
A. �Ͻ�ȴ��������нϺõ����ܣ�һ������£�Ӳ�ȱȴ������ߣ��۵�ȴ������ĵ�
B. �Ͻ���Ȼ���н�������
C. ���õ�ⷨұ���ơ�þ�����Ȼ��ý���
D. ����բ�����Դ�����������ɷ�ֹ���ں�ˮ�б���ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ������ˮ���Ȼ����Һ��ϵõ�c(NH3��H2O)+c(NH4+)=0.1 mol��L-1�Ļ����Һ����Һ��c(NH3��H2O)��c(NH4+)��pH�Ĺ�ϵ��ͼ��ʾ�������й�����Ũ�ȹ�ϵ����һ����ȷ����( ) 
A��W���ʾ��Һ�У�c(NH4+)+c(H+)=c(OH-)
B��pH=10.5��Һ�У�c(Cl-)+c(OH-)+c(NH3��H2O)<0.1 mol��L-1
C��pH=9.5��Һ����c(NH3��H2O)>c(NH4+)>c(OH-)>c(H+)
D����W������ʾ��1 L��Һ�м���0.05 mol NaOH����(������Һ����仯)��c(Cl-)>c(Na+)>c(OH-)>c(N H4+)>c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ�м�������Na2O2�����ܴ����������������
A. NH![]() ��Ba2����Cl����NO
��Ba2����Cl����NO![]()
B. K����AlO![]() ��Cl����SO
��Cl����SO![]()
C. Ca2����Mg2����NO![]() ��HCO
��HCO![]()
D. Na����Cl����CO![]() ��SO
��SO![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com