
【题目】根据所学知识回答下列问题。
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的![]() 和
和![]() 单质燃烧时均放出大量热,可用作燃料.已知
单质燃烧时均放出大量热,可用作燃料.已知![]() 和
和![]() 为短周期元素,其原子的第一至第四电离能如下表所示:
为短周期元素,其原子的第一至第四电离能如下表所示:
电离能/ |
|
|
|
|
| 932 | 1821 | 15390 | 21771 |
| 738 | 1451 | 7733 | 10540 |
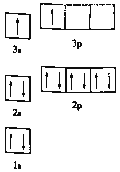
①某同学根据上述信息,推断![]() 的核外电子排布如图所示,该同学所画的电子排布图违背了_________,
的核外电子排布如图所示,该同学所画的电子排布图违背了_________, ![]() 元素位于周期表五个区域中的___ 区。
元素位于周期表五个区域中的___ 区。
②![]() 分子的中心原子
分子的中心原子![]() 采取_________杂化,
采取_________杂化, ![]() 的空间构型为___ 。
的空间构型为___ 。
(2)![]() 原子或离子外围有较多能量相近的空轨道,所以其能与一些分子或离子形成配合物。
原子或离子外围有较多能量相近的空轨道,所以其能与一些分子或离子形成配合物。
① 与![]() 原子或离子形成配合物的分子或离子应具备的结构特征是____。
原子或离子形成配合物的分子或离子应具备的结构特征是____。
② 六氰合亚铁离子![]() 中不存在____________(填字母)。
中不存在____________(填字母)。
A.共价键 B.非极性键 C.配位键 D. ![]() 键
键
写出一种与![]() 互为等电子体的单质的分子式:________________ 。
互为等电子体的单质的分子式:________________ 。
(3)—种![]() 合金的晶胞结构如图,请据此回答下列问题:
合金的晶胞结构如图,请据此回答下列问题:
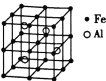
① 该合金的化学式为____________。
② 若晶体的密度为![]()
![]() ,则该晶胞棱长为____________
,则该晶胞棱长为____________![]() (设
(设![]() 为阿伏加德罗常数的值,用含
为阿伏加德罗常数的值,用含![]() 和
和![]() 的代数式表示,不必化简)。
的代数式表示,不必化简)。
【答案】能量最低原理s![]() 直线形具有孤对电子B
直线形具有孤对电子B![]()
![]()
![]()
【解析】
(1)①由图1电子轨道排布图可知,3s能级未填满就填充3p能级,2p能级的轨道内有自旋方向相同的2个电子,所以违背能量最低原理与泡利原理.由表中电离能可知,二者第三电离能剧增,故为+2价,都为短周期元素,故A为铍、B为Mg,镁价层电子排布为3s2,处于周期表中s区,故答案为:能量最低原理;s;
②BeCl2分子中Be的成2个σ键,杂化轨道数为2,采取sp杂化,没有孤对电子对,为直线型,故答案为:sp;直线;
(2)①形成配离子具备的条件为:中心原子具有空轨道,配体具有孤对电子对,故答案为:具有孤对电子;
②六氰合亚铁离子[Fe(CN)6]4-中Fe2+与CN-形成配位键,CN-中存在C≡N三键,为极性共价键,三键中有1个σ键2个π键,所以CN-中共价键、配位键、σ键、π键;CN-中C原子与1个单位负电荷用N原子替换可得CN-等电子体的单质为N2,故答案为:B;N2;
(3)①由晶胞图示可知,晶胞中含有4个Al原子,且都位于晶胞内部,则晶胞平均含有4个Al,晶胞中Fe位于顶点的有8个,位于面心的有6个,位于棱上的有12个,位于体心的有1个,含有Fe原子数目为8×![]() +6×
+6×![]() +12×
+12×![]() +1=8,Fe与 Al原子数目之比为8:4=2:1,故该合金的化学式为Fe2Al,故答案为:Fe2Al;
+1=8,Fe与 Al原子数目之比为8:4=2:1,故该合金的化学式为Fe2Al,故答案为:Fe2Al;
②一个晶胞中含有8个Fe原子和4个Al原子,晶胞的质量为![]() g,棱长为
g,棱长为![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 碳酸钙与盐酸反应:CO32++2H+=H2O+CO2↑
B. 将氯气溶于水制备次氯酸:Cl2+H2O =H++Cl-+HClO
C. 氢氧化钡溶液与稀H2SO4 反应:Ba2++SO42-=BaSO4↓
D. 氯化亚铁溶液中通入氯气:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”。下列错误的是( )
A. 煤、石油和天然气都属于碳素燃料B. 发展太阳能经济有助于减缓温室效应
C. 太阳能电池将太阳能直接转化为电能D. 菠菜蛋白质“发电”不属于“太阳能文明”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
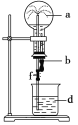
a(干燥气体) | b(液体) | |
A | NO | 水 |
B | CO2 | 4 mol/L NaHCO3溶液 |
C | Cl2 | 饱和NaCl水溶液 |
D | NH3 | 1 mol/L盐酸 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3S + 6KOH = 2K2S + K2SO3+ 3H2O反应中,作氧化剂的S原子与作还原剂的S原子的物质的量之比是:
A.1∶2B.2∶1C.1∶3D.3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市售照明材料LED晶片是一种发光二极管。材质组成为:GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、GaInN(氮化镓铟)等。请回答下列问题:
(1)砷基态原子的核外电子排布式为______________________。
(2)上述非金属元素氢化物的沸点从高到低的顺序为___________。
(3)下列说法正确的是___________
a.电负性:As<Ga b.SiC与GaAs互为等电子体 c.第一电离能:As>Se>Ga
(4)如图所示为GaAs的晶胞结构,晶体熔点为1237℃。
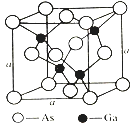
①晶胞中砷与镓原子间的化学键类型有___________。
②一个镓原子周围所有距离最近且相等的砷原子形成的空间构型是___________。
③一个晶胞的组成为___________。
④已知晶胞棱长a=5.64×10-10m,则该晶胞密度为ρ=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组辨析以下说法:①粗盐和酸雨都是混合物;②非金属氧化物一定都是酸性氧化物;③冰和干冰既是纯净物又是化合物;④Na2O、Na2O2都是钠的氧化物,都是碱性氧化物;⑤磷酸和醋酸都是多元酸;⑥纯碱和烧碱都是碱。其中正确的是( )
A.②③⑥B.①②④C.①③D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL1.0mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是
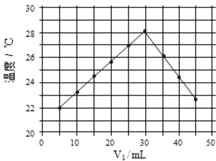
A. 做该实验时环境温度为22℃ B. 该实验表明热能可转化为化学能
C. NaOH溶液的浓度约为1.5mol·L-1 D. 该实验表明有水生成的反应都是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com