
【题目】下列化学用语或命名正确的是
A.含有10个中子的氧原子的符号:![]() B.次氯酸的结构式:HClO
B.次氯酸的结构式:HClO
C.S2的结构示意图:![]() D.NH4Cl的电子式:
D.NH4Cl的电子式:![]()
【答案】A
【解析】
A.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
B.次氯酸的中心原子为O原子,分子中不存在H-Cl键;
C.硫离子的核电荷数为16,核外电子总数为18,最外层达到8电子稳定结构;
D.氯离子为阴离子,电子式中需要标出最外层电子;
A.氧原子的质子数为8,含有10个中子的氧原子的质量数为18,其表示方法为:![]() ,故A正确;
,故A正确;
B.次氯酸为共价化合物,分子中含有1个H-O键和1个O-Cl键,其正确的结构式为H-O-Cl,故B错误;
C.![]() 为硫原子结构示意图,S2-的质子数为16,核外电子数为18,各层电子数分别为2、8、8,硫离子正确的结构示意图为:
为硫原子结构示意图,S2-的质子数为16,核外电子数为18,各层电子数分别为2、8、8,硫离子正确的结构示意图为: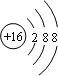 ,故C错误;
,故C错误;
D.氯化铵为离子化合物,铵根离子和氯离子都需要标出所带电荷及最外层电子,正确的电子为![]() ,故D错误;
,故D错误;
答案为A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)Co(NH3)5BrSO4可形成两种钴的配合物,已知两种配合物的分子式分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br,分别向两种配合物的溶液中加BaCl2溶液,有白色沉淀产生的是_____。
(2)向CuSO4溶液中逐滴加入稀氨水,所得配合物的化学式为_____,该配合物中存在的化学键类型为_________。
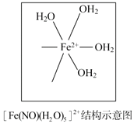
(3)铁可形成多种配位化合物,但与氨形成的化合物不稳定,如FeCl2虽然可以与氨气形[Fe(NH3)6]Cl2,但此物质遇水即生成灰白色沉淀,写出对应的反应方程式:_____。[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol·L-1·min-1。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol·L-1·min-1。求:
(1)5 min后B的浓度c(B)=________mol·L-1,反应开始前容器中的A、B的物质的量:n(A)=n(B)=________mol。
(2)A的平均反应速率:v(A)=________mol·L-1·min-1。
(3)x的值为________。
(4)下列叙述能表明该反应已达平衡状态的是_________(填序号)。
①A的物质的量浓度不变
②3v正(A)=v逆(B)
③混合气体总物质的量不变
④反应物和生成物同时存在,反应体系中四种物质的物质的量均相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高性能钠型电池工作原理如图。(NaSn为合金)其电池反应为Cx(PF6)+NaSn![]() Cx+Sn+NaPF6,下列说法不正确的是( )
Cx+Sn+NaPF6,下列说法不正确的是( )
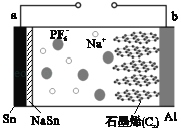
A. 放电时,b为正极
B. 充电时,阴极反应为Sn+Na++e﹣═NaSn
C. 放电时,负极材料Sn在很大程度上被腐蚀
D. 充电时,PF6﹣向右迁移并嵌入石墨烯中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原子结构的说法中正确的是
A.卢瑟福根据![]() 粒子散射现象提出“葡萄干面包式”的原子结构模型
粒子散射现象提出“葡萄干面包式”的原子结构模型
B.原子中,核对核外电子吸引作用实质是核内的质子对核外电子的吸引
C.质子数决定元素的种类,中子数决定核素的种类
D.所有的原子都含有质子、中子和电子3种基本粒子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化为放热反应的是( )
A.H2O(g)=H2O(l) △H=-44.0 kJ/mol
B.2HI(g)=H2(g)+I2(g) △H=+14.9 kJ/mol
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如图所示的化学反应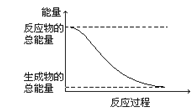
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量X气体通入Y溶液中,实验结果与预测的现象一致的组合是
X气体 | Y溶液 | 预测的现象 |
| |
① | CO2 | 饱和Na2CO3溶液 | 白色沉淀析出 | |
② | SO2 | Ba(NO3)2溶液 | 白色沉淀析出 | |
③ | Cl2 | AgNO3溶液 | 白色沉淀析出 | |
④ | NH3 | AlCl3溶液 | 白色沉淀析出 |
A. 只有①②③ B. 只有①②④ C. 只有①③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Cu的价电子排布图______,钾的最高能层符号______。
(2)NH3在水中的溶解度大于H2S在水中的溶解度其原因是______。
(3)用“>、<、=”来比较下列晶体的熔沸点。
CaO______MgO HF______HCl Si______SiC K______Ti
(4)某金属晶体堆积方式为面心立方堆积,其配位数为______;一个该金属晶胞中含有______个该金属原子。
(5)NH3与NH4+的键角大小,NH3______NH4+(用“>、<、=”比较),原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.56 g Cu和一定量的浓硝酸反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12 L(标准状况),则反应中消耗HNO3的物质的量为 ( )
A.0.13 molB.1 molC.1.05 molD.0.05 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com