
【题目】化合物KxFe(C2O4)yzH2O是一种重要的光化学试剂,其中铁为![]() 价。分别取该样品0.491g两份,其中一份在110℃干燥脱水,至质量恒定为0.437g。另一份置于锥形瓶中,加入足量的3molL-1 H2SO4和适量的蒸馏水,加热到
价。分别取该样品0.491g两份,其中一份在110℃干燥脱水,至质量恒定为0.437g。另一份置于锥形瓶中,加入足量的3molL-1 H2SO4和适量的蒸馏水,加热到![]() ,趁热加入0.0500molL-1KMnO4溶液24.0mL恰好完全反应;再向溶液中加入适量的某种还原剂,将Fe3+ 完全转化为Fe2+,该溶液中Fe2+刚好与4.0mL0.0500molL-1 KMnO4溶液完全反应。下列分析结果错误的是( )
,趁热加入0.0500molL-1KMnO4溶液24.0mL恰好完全反应;再向溶液中加入适量的某种还原剂,将Fe3+ 完全转化为Fe2+,该溶液中Fe2+刚好与4.0mL0.0500molL-1 KMnO4溶液完全反应。下列分析结果错误的是( )
A.0.491g样品中结晶水的物质的量0.003mol
B.向溶液中加入适量NaBr溶液,可将Fe3+完全转化为Fe2+
C.化合物中草酸根的质量分数![]()
D.化合物的化学式K3Fe(C2O4)33H2O
【答案】B
【解析】
A.准确称取A样品0.491g,干燥脱水至恒重,减少的质量为结晶水的质量,其中一份在110℃干燥脱水,至质量恒定为0.437g,n(H2O)=![]() =0.003mol,故A正确;
=0.003mol,故A正确;
B.向溶液中加入适量的某种还原剂,将Fe3+ 完全转化为Fe2+,说明该还原剂的还原性比Fe2+强,而实际上还原性Fe2+>Br-,故该还原剂不可能为NaBr,故B错误;
C.另取A样品0.491g置于锥形瓶中,加入足量的3mol/L的H2SO4溶液和适量蒸馏水,再加入0.050mol/L的KMnO4溶液24.0mL,微热,恰好完全反应:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O可知:n(C2O42-)=![]() n(KMnO4)=
n(KMnO4)=![]() ×0.05mol/L×0.024L=0.003mol,草酸根的质量分数为
×0.05mol/L×0.024L=0.003mol,草酸根的质量分数为![]() ×100%=53.8%,故C正确;
×100%=53.8%,故C正确;
D.化合物KxFe(C2O4)yzH2O是一种重要的光化学试剂,其中铁为+3价,n(C2O42-)=0.003mol;根据MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,n(Fe2+)=5n(KMnO4)=5×0.05mol/L×0.004L=0.001mol,由离子守恒知n(K+)=0.003mol,样品[KxFe(C2O4)yzH2O中x∶1∶y∶z=n(K+)∶n(Fe3+)∶n(C2O42-)∶n(H2O)=3∶1∶3∶3,故化学式为K3Fe(C2O4)33H2O,故D正确;
故选B。


 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】下列实验不能达到预期实验目的是()
序号 | 实验内容 | 实验目的 |
A | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一会过滤 | 除去MgCl2中少量FeCl3 |
D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列判断正确的是
A. 标准状况下,2.8 g 14C18O中质子数为1.4NA
B. 常温下,0.3 mol NO2通入水中完全反应,转移的电子数为0.2NA
C. CO燃烧热为283.0 kJ/mol,若一定量的CO完全燃烧放出热量为283.0 kJ,则消耗O2分子数为NA
D. 62.0 g乙二醇中含有的羟基数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
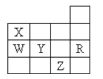
A.常压下五种元素的单质中Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的稳定性比X的氢化物的稳定性强
D.Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种气体麻醉剂,可由“可燃冰”为原料合成。回答下列问题:
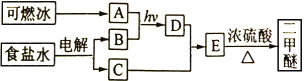
(1)B为黄绿色气体,其化学名称为____________。
(2)由A和B生成D的化学方程式为__________________。
(3)E的结构简式为____________。
(4)由E生成二甲醚的反应类型为______________________。
(5)二甲醚的同分异构体的结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 都是元素周期表中前四周期的元素,它们的核电荷数依次增大。其中
都是元素周期表中前四周期的元素,它们的核电荷数依次增大。其中![]() 与
与![]() 、
、![]() 与
与![]() 在周期表中相邻,
在周期表中相邻,![]() 原子核外有两个未成对电子,
原子核外有两个未成对电子,![]() 的第一电离能比同周期相邻两种元素的都大,
的第一电离能比同周期相邻两种元素的都大,![]() 原子在同周期元素原子中半径最大(稀有气体原子除外);
原子在同周期元素原子中半径最大(稀有气体原子除外);![]() 与
与![]() 位于不同周期,
位于不同周期,![]() 原子核外最外层电子数与
原子核外最外层电子数与![]() 相同,其余各电子层均充满电子。请根据以上信息,回答下列问题。
相同,其余各电子层均充满电子。请根据以上信息,回答下列问题。
(1)![]() 、
、![]() 、
、![]() 、
、![]() 四种元素的电负性由大到小的排列顺序为_________。
四种元素的电负性由大到小的排列顺序为_________。
(2)![]() 的氢化物的结构式为_________,其分子的空间构型为________。
的氢化物的结构式为_________,其分子的空间构型为________。
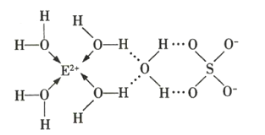
(3)![]() 的某种化合物的结构如图所示,已知微粒间的相互作用包括化学键和分子间作用力,则此化合物中各种粒子间的相互作用力有___________。
的某种化合物的结构如图所示,已知微粒间的相互作用包括化学键和分子间作用力,则此化合物中各种粒子间的相互作用力有___________。
(4)![]() 与
与![]() 的气态氢化物相比,_________(填化学式,下同)的沸点更高;
的气态氢化物相比,_________(填化学式,下同)的沸点更高;![]() 与
与![]() 的气态氢化物相比,________的沸点更高。
的气态氢化物相比,________的沸点更高。
(5)![]() 的稳定氧化物中,中心原子采取________杂化,该氧化物分子的空间构型为______。
的稳定氧化物中,中心原子采取________杂化,该氧化物分子的空间构型为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线中,可以描述乙酸(甲, Ka=1.8×10-5)和一氯乙酸(乙, Ka=1.4×10-3)在水中的电离度与浓度关系的是()

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,向20.00mL 0.100 mol·L![]() HX中滴加0.100 mol·L
HX中滴加0.100 mol·L![]() NaOH过程中,pH变化如下图所示。
NaOH过程中,pH变化如下图所示。
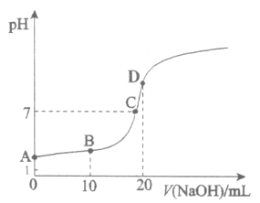
(1)写出HX的电离方程式:__________。
(2)下列有关B点溶液的说法正确的是__________(填字母序号)。
a. 溶质为:HX、NaX
b. 微粒浓度满足:c(Na+)+c(H+)=c(X-)+c(OH-)
c. 微粒浓度满足:c(Na+)=c(HX)+c(X-)
d. 微粒浓度满足:c(X-)>c(Na+)>c(H+)>c(OH-)
(3)A、C两点水的电离程度:A__________C(填“>”、“<”或“=”)。
(4)C点对应离子浓度由大到小的顺序为__________。
(5)用离子方程式解释D点溶液pH>7的原因:_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com