
下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式回答以下问题:
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | | | | | ① | | ② | |
| 三 | ③ | ④ | ⑤ | ⑥ | | | ⑦ | ⑧ |
| 四 | ⑨ | | | | | | ⑩ | |
(1)K
(2)
(3)HClO4,KOH,Al(OH)3
(4)Na ,Cl ;(5)Cl2,2NaBr+Cl2=2NaCl+Br2
解析试题分析:(1)同周期的元素,从左到右,元素的金属性逐渐减弱,非金属性逐渐增强。从上到下,元素的金属性逐渐增强,非金属性逐渐减弱。所以金属性最强的 元素是⑨元素K。(2)对于惰性气体元素来说,原子的最外层达到了2个或8个电子的稳定结构,化学性质最不活泼。所以化学性质最不活泼的元素是⑧元素Ar.其原子结构示意图为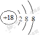 .(3)在表格中元素的非金属性最强的是②元素F。但其没有含氧酸。在其余的元素中,非金属性最强的是⑦元素Cl,它的最高价氧化物对应的水化物中酸性最强的是HClO4。金属性最强的元素是⑨元素K。元素的金属性越强,其对应的最高价氧化物的水化物碱性最强。所以碱性最强的是KOH。Al(OH)3既能与酸反应生成盐和水,也能与碱反应生成盐和水。是两性氢氧化物。因此呈两性的氢氧化物是Al(OH)3。(4)③~⑦元素是同一周期的元素,从左到右,随着原子序数的增大,原子半径逐渐减小。所以原子半径最大的是Na,原子半径最小的是Cl。(5)⑦元素的单质Cl2与⑩元素的单质Br2,元素的非金属性越强,元素相应的单质的氧化性就越强。由于非金属性Cl>Br。所以单质化学性质较活泼的是Cl2。活动性强的元素的单质能把活动性弱的从化合物中置换出来。Cl2+2NaBr=2NaCl+Br2.
.(3)在表格中元素的非金属性最强的是②元素F。但其没有含氧酸。在其余的元素中,非金属性最强的是⑦元素Cl,它的最高价氧化物对应的水化物中酸性最强的是HClO4。金属性最强的元素是⑨元素K。元素的金属性越强,其对应的最高价氧化物的水化物碱性最强。所以碱性最强的是KOH。Al(OH)3既能与酸反应生成盐和水,也能与碱反应生成盐和水。是两性氢氧化物。因此呈两性的氢氧化物是Al(OH)3。(4)③~⑦元素是同一周期的元素,从左到右,随着原子序数的增大,原子半径逐渐减小。所以原子半径最大的是Na,原子半径最小的是Cl。(5)⑦元素的单质Cl2与⑩元素的单质Br2,元素的非金属性越强,元素相应的单质的氧化性就越强。由于非金属性Cl>Br。所以单质化学性质较活泼的是Cl2。活动性强的元素的单质能把活动性弱的从化合物中置换出来。Cl2+2NaBr=2NaCl+Br2.
考点:考查元素周期表、元素周期律的应用的知识。


科目:高中化学 来源: 题型:填空题
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);D原子的基态电子排布式为___________________________________。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC的空间构型为________(用文字描述)。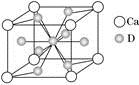 (3)1 mol AB-中含有的π键个数为________。
(3)1 mol AB-中含有的π键个数为________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是________。
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
 W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2
W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2 17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。
17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
位于短周期的四种元素A、B、C、D,其原子序数依次增大。A在周期表中原子半径
最小;B是地壳中含量最高的元素;B、D位于同一主族;C的原子半径在同周期中最大。回答下列问题:
(1)写出由上述元素形成的具有漂白作用的3种物质的化学式: 、 、 。
(2)写出含B元素质量分数最高的化合物的电子式: 。
(3)分别由A、B、C、D四种元素组成的两种化合物X和Y可以发生反应,试写出该反应的离子方程式: 。
(4)用电子式表示化合物C2B的形成过程: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)有X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,此氢化物的分子量与X最高价氧化物的分子量之比为17:40,X原子核内质子数与中子数相等,Y与X可以形成离子化合物Y2X,Y的阳离子电子层结构与Ne相同,Z与X同周期,其气态单质是双原子分子,两原子共用1对电子。试回答:
(1)写出各元素符号:X 、Y 、Z 。
(2)X离子的结构示意图为 。X与Y形成的离子化合物的电子式为 , Z和氢形成的化合物的电子式为 。
(3)Y单质在空气中燃烧的化学方程式为 ,生成物与水反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。
| 元素 | 信息 |
| B | 其单质在常温下为双原子分子,与A可形成分 子X,X的水溶液呈碱性 |
| D | 其简单阳离子与X具有相同电子数,且是同周 期中简单阳离子中半径最小的 |
| E | 元素原子最外层比次外层少2个电子 |
| C、F | 两种元素的原子最外层共有13个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物对应水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ,B ,C ,D ,E 。
。
(2)写出A、B两元素最高价氧化物对应水化物相互反应的化学方程式: ________________。
(3)比较C、D的最高价氧化物对应水化物的酸性:(用化学式表示) ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题。
(1)砷的基态原子的电子排布式为 。
(2)N、P、As原子的第一电离能由大到小的顺序为 。
(3)NH3的沸点比PH3高,原因是 ;PO43-离子的立体构型为 。
(4)PH3分子中P原子采用 杂化。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因 。
(6)CuCl2与氨水反应可形成配合物[Cu(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如图转化关系。回答下列问题:
(1) 若X基态原子外围电子排布式为3s2,甲是由第二周期两种元素的原子构成的气态化合物分子, Y基态原子的轨道表示式为 ,甲的电子式为
(2)若X原子的价电子排布为ns(n-1)np(n+2),常温下Y为易挥发的液体物质、乙为无色易溶于水的气体。则Z为 ,组成Y的元素的基态原子的电子排布式为 。
(3)若X、Y均为金属单质,X基态原子外围电子排布式为3s23p1,甲为具有磁性的黑色固体,则X与甲反应的化学方程式为: ,Y2+离子的电子排布式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com