
(10分)有X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,此氢化物的分子量与X最高价氧化物的分子量之比为17:40,X原子核内质子数与中子数相等,Y与X可以形成离子化合物Y2X,Y的阳离子电子层结构与Ne相同,Z与X同周期,其气态单质是双原子分子,两原子共用1对电子。试回答:
(1)写出各元素符号:X 、Y 、Z 。
(2)X离子的结构示意图为 。X与Y形成的离子化合物的电子式为 , Z和氢形成的化合物的电子式为 。
(3)Y单质在空气中燃烧的化学方程式为 ,生成物与水反应的化学方程式为 。
(1)S,Na,Cl
(2) ,
,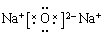 ,
, 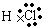
(3)2Na + O2 Na2O2,2Na2O2 + 2H2O =" 4NaOH" + O2↑。
Na2O2,2Na2O2 + 2H2O =" 4NaOH" + O2↑。
解析试题分析:短周期元素,X的气态氢化物化学式为H2X,此氢化物的分子量与X最高价氧化物的分子量之比为17:40。则X是S;Y与X可以形成离子化合物Y2X,Y的阳离子电子层结构与Ne相同,则Y是Na;Z与X同周期,其气态单质是双原子分子,两原子共用1对电子。则Z是Cl.(1)X是S;Y是Na;Z是Cl。(2)S2-的结构示意图为 ,Na与S形成的化合物Na2S的电子式为
,Na与S形成的化合物Na2S的电子式为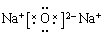 。H、Cl形成的化合物HCl的电子式为:
。H、Cl形成的化合物HCl的电子式为: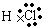 。(3)Na在空气中燃烧的方程式为2Na + O2
。(3)Na在空气中燃烧的方程式为2Na + O2 Na2O2;生成物Na2O2与水反应的化学方程式为2Na2O2 + 2H2O =" 4NaOH" + O2↑。
Na2O2;生成物Na2O2与水反应的化学方程式为2Na2O2 + 2H2O =" 4NaOH" + O2↑。
考点:考查元素的推断及原子结构示意图、离子化合物、共价化合物的电子式表示、方向方程式的书写。


科目:高中化学 来源: 题型:填空题
[化学——选修3: 物质结构与性质](15分)
Sn是人类最早使用的元素之一,能形成SnCl2,SnCl4两种氯化物,SnCl2常温下为白色晶体,具有一维链状的聚合结构,气态时以单分子形式存在,而SnCl4常温下为无色液体。白锡和灰锡是Sn的两种同素异形体,白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似。白锡的密度大于灰锡的密度。
(1)Sn元素价层电子排布式为 。
(2)SnCl2的一维链状聚合结构如图所示,在分子结构中标出
所含有的配位键。其固体分子及气体分子中Sn的杂化方式为 。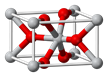
(3)SnCl4分子的空间构型为 ,SnCl4与CCl4中
沸点较高的是 。
(4)锡的某种氧化物的晶胞如右图,其化学式为 。
(5)解释白锡分子的密度大于灰锡的密度的原因: 。
(6)若灰锡的晶胞边长为a pm,计算灰锡的密度 为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最处层电子数相同。回答下列问题:
(1)X、Y和Z的元素符号分别为 、 、 。
(2)由上述元素组成的化合物中,既含有共价键又含有离子键的有 、 。
(3)X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是 。此化合物在酸性条件下与高锰酸钾反应的离子方程式为 ;此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al与NaOH溶液反应的离子方程式为 。
(2)下列实验能比较镁和铝的金属性强弱的是 (填序号)。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/LAlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al (s)+3O2(g) =2Al2O3(s) ΔH1 =" -3352" kJ/mol
Mn(s)+ O2(g) =MnO2 (s) ΔH2 =" -521" kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是 。
(4)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为 。
(5)工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g) + 2N2(g) + 6H2(g) Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是 mol/(L·min)。
②若按n(SiCl4) : n(N2) : n(H2) =" 3" : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应 (填“增大”、“减小”或“不变”)。
(6)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp= 。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10-5mol·L-1,需调节pH为 以上。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原
子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)写出D与E以1∶1的原子个数比形成的化合物的电子式: 。F的原子结构示意图为: 。
(2)B、D形成的化合物BD2中存在的化学键为 键(填“离子”或“共价”,下同)。A、C、F三种元素形成的化合物CA4F为 化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为: 。
(4)A、C、D、E的原子半径由大到小的顺序是 (用元素符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性 于F(填“强”或“弱”),并用化学方程式证明上述结论 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式回答以下问题:
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | | | | | ① | | ② | |
| 三 | ③ | ④ | ⑤ | ⑥ | | | ⑦ | ⑧ |
| 四 | ⑨ | | | | | | ⑩ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物能电离出电子数相等的阴、阳离子。A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层电子数的3倍,B、C的最外层电子数之和与D的最外层电子数相等。E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏。请回答下列问题:
(1)C的最高价氧化物对应水化物的化学式为 ,
其中含有的化学键类型为 。
(2)由上述A、B、C、D四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为 。
(3)E元素与D元素可形成ED2和ED3两种化合物,下列说法正确的是 (填序号)。
①保存ED2溶液时,需向溶液中加入少量E单质
②ED2只能通过置换反应生成,ED3只能通过化合反应生成
③铜片、碳棒和ED3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴ED3的浓溶液,原无色溶液都变成紫色
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1~18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物,其晶胞结构如图所示。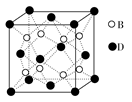
请回答:
(1)A元素的名称是 。
(2)B的元素符号是 ,C的元素符号是 ,B与A形成的化合物比C与A形成的化合物沸点高,其原因是 。
(3)E属元素周期表中第 周期,第 族的元素,其元素名称是 ,它的+2价离子的电子排布式为 。
(4)从图中可以看出,D跟B形成的离子化合物的化学式为 ;该离子化合物晶体的密度为ag·cm-3,则晶胞的体积是 (只要求列出算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。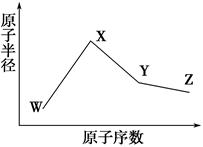
(1)X位于元素周期表中第________周期第________族;W的基态原子核外有________个未成对电子。
(2)Z的气态氢化物和溴化氢相比,较稳定的是________________(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com