
【题目】Ⅰ.实验室要配制100 mL物质的量浓度为0.1mol/L的KMnO4溶液,回答问题:
(1)要配制上述溶液,所需仪器除天平、药匙、烧杯、玻璃棒、胶头滴管外,还需要___;
(2)根据计算,所需KMnO4固体的质量为___g(取小数点后两位);
(3)下列操作会导致所配溶液浓度偏低的是___(填选项代号)。
A.定容时加水超过刻度线,用胶头滴管吸出一些
B.定容时仰视刻度线
C.转移溶液后,没有洗涤烧杯内壁
D.配制前容量瓶内壁仍残留有蒸馏水
E.转移溶液时部分溶液溅出
Ⅱ.KMnO4是一种强氧化剂, 加酸酸化能够提高其氧化性,通常用硫酸酸化而不能用盐酸酸化,原因是KMnO4可以和盐酸发生反应。
(4)用双线桥法分析反应:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O___。该反应中,还原产物是___。
(5)若转移的电子数为0.4mol,则产生标况下气体体积为___。
【答案】100mL容量瓶 1.58g ABCE 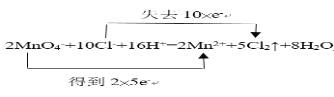 Mn2+ 4.48L
Mn2+ 4.48L
【解析】
I.配制步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,首先计算所需溶质的质量或体积,一般固体用天平称质量,液体用量筒量取体积,把溶质倒入烧杯进行溶解,冷却后转移到容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至液面和刻度线相平,然后摇匀,装瓶,贴标签,即完成溶液的配制;
II.根据氧化还原反应规律进行该反应中10e----5Cl2关系进行计算。
(1)配制步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般天平称量固体,把高锰酸钾倒入烧杯进行溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器有玻璃棒、天平、药匙、烧杯、胶头滴管、100mL容量瓶,所以还需要100mL容量瓶,
答案为:100mL容量瓶;
(2)![]() 的物质的量为
的物质的量为![]() ,
,![]() 的质量为
的质量为![]() ,
,
故答案为:1.58g;
(3)A.定容时加水超过刻度线,用胶头滴管吸出一些,导致溶质的物质的量偏小,配制的溶液浓度偏低;
B.定容时仰视,导致溶液的体积偏大,所以配制溶液的浓度偏低;
C.转移溶液后,没有洗涤烧杯内壁,导致溶质的物质的量偏小,配制的溶液浓度偏低;
D.配制前容量瓶内壁仍残留有蒸馏水,对溶质的物质的量和溶液的体积无影响,所以配制的溶液浓度无影响;
E.转移溶液时部分溶液溅出容量瓶外,导致溶质的物质的量偏小,配制的溶液浓度偏低;
故答案为:ABCE;
(4)![]() 该反应中锰元素化合价降低得电子,氯元素化合价升高失电子,故双线桥为:
该反应中锰元素化合价降低得电子,氯元素化合价升高失电子,故双线桥为: ,还原产物是化合价降低后得到的产物,即
,还原产物是化合价降低后得到的产物,即![]() ,
,
故答案为: ;
;![]() ;
;
(5)![]() 该反应转移了10个电子,即转移10个电子生成5个氯气,故转移0.4mol电子时生成氯气0.2mol,标况下体积为4.48L,
该反应转移了10个电子,即转移10个电子生成5个氯气,故转移0.4mol电子时生成氯气0.2mol,标况下体积为4.48L,
答案为: 4.48L。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)0. 6 g H2中含有氢原子的物质的量为_________ mol。
(2)标准状况下,含有相同氧原子数的CO和CO2的体积之比为____________。
(3)100mL硫酸钠溶液中n(Na+)=0.2mol,则其中c(SO42-)=_____________。
(4)6.72L(标准状况)CO与一定量的Fe2O3恰好完全反应,生成Fe的质量为____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是
A.原子数目相等的三种气体,质量最大的是Z
B.同温同压下,同质量的三种气体,气体密度最小的是X
C.同温同压下,三种气体体积均为6.72 L,则它们的物质的量一定均为0.3 mol
D.同温下,体积相同的两容器分别充入2 g Y气体和1 g Z气体,则其压强比为2︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列水溶液中的电离方程式或发生反应的离子方程式:
(1)小苏打溶于水___;
(2)用稀硫酸除掉镁条表面的氧化膜___;
(3)用胃舒平(有效成分是Al(OH) 3)治疗胃酸(主要成分是盐酸)过多___;
(4)用锌粉除去硫酸钾溶液中的Cd2+杂质(置换反应)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。

(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂排出的废液主要含Zn(NO3)2和AgNO3,为了从中回收金属银和硝酸锌,某中学化学课外活动小组设计了以下的实验步骤:(已知:银可溶于硝酸;Zn(NO3)2高温下易分解,Zn(NO3)2的溶解度在溶液中受温度的影响较大)
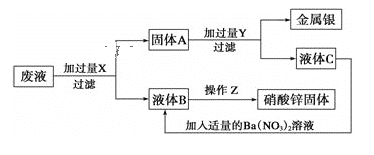
(1)X、Y分别是X:___,Y:___。(写化学式)
(2)固体A的主要成分是___。(写化学式)
(3)Z处进行的实验操作是:先过滤,将滤液___、___、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、容积为2L的密闭容器中通入1mol X和2mol Y,发生反应:X(s)+2Y(g) ![]() 3Z(g) ΔH=-a kJ/mol (a>0),5min末测得Z的物质的量为1.2mol。则下列说法正确的是
3Z(g) ΔH=-a kJ/mol (a>0),5min末测得Z的物质的量为1.2mol。则下列说法正确的是
A. 若反应体系中气体的压强保持不变,说明反应达到了平衡状态
B. 0~5min,X的平均反应速率为0.04mol ·L-1·min-1
C. 达到平衡时,反应放出的热量为a kJ
D. 达到平衡时,Y和Z的浓度之比一定为2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)“水玻璃”中溶质的化学式为____,乙二醇的结构简式为____。
(2)AlCl3熔沸点较低,熔融状态不导电,则其晶体类型为____晶体。
(3)浓硝酸需避光保存在棕色试剂瓶的原因是____。(用化学方程式解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1,Na2O2(s)+CO2(g)=Na2CO3(s)+ ![]() O2(g) ΔH=-266kJ·mol-1,试回答:
O2(g) ΔH=-266kJ·mol-1,试回答:
(1)CO的燃烧热ΔH=_______________。
(2)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为:________。
(3)工业废气中的CO2可用碱液吸收,所发生的反应如下:CO2(g)+2NaOH(aq)=Na2CO3(aq)+H2O(l) ΔH=-a kJ·mol-1,CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-bkJ·mol-1,则:
①CO2(g)+H2O(l)+Na2CO3(aq)=2NaHCO3(aq)的ΔH=________kJ·mol-1(用含a、b的代数式表示)。
②标况下,11.2LCO2与足量的NaOH溶液充分反应后,放出的热量为_______kJ(用含a或b的代数式表示)。
(4)根据以下三个热化学方程式:2H2S(g)+3O2(g)= 2SO2 (g) +2H2O (l) ΔH=-Q1kJ·mol-1,2H2S(g)+O2(g)= 2S (s) +2H2O (l) ΔH=-Q2kJ·mol-1,2H2S(g)+O2(g)=2 S (s) +2H2O (g) ΔH=-Q3kJ·mol-1,判断Q1、Q2、Q3的大小关系是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com