
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知lmol SO2(g)氧化为1mol SO3(g)的△H=-99kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知lmol SO2(g)氧化为1mol SO3(g)的△H=-99kJ·mol-1

请回答下列问题:
(1)图中E表示________________,该反应通常用V2O5作催化剂,加V2O5会使图中B点____ (填“升高”“降低”“不变”)
(2)图中△H=_____kJ·mol-1;
(3)如果反应速率v(SO2)为0.05 mol·L-1·min-1,则v(O2)=_____ mol·L-1·min-1;
(4)己知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 mol SO3(g)放热____kJ;
(5)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g) ![]() xC(g)+2D(g),5min 后测得 c(D)=0.5 mol·L-1,c(A):c(B)=3:5,C的反应速率是0.1 mol·L-1·min-1。x=_____________;
xC(g)+2D(g),5min 后测得 c(D)=0.5 mol·L-1,c(A):c(B)=3:5,C的反应速率是0.1 mol·L-1·min-1。x=_____________;
(6)的在一定条件下,可逆反应:mA+nB![]() pC达到平衡,若:
pC达到平衡,若:
①A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的大小关系是______;
②加热后,可使C的质量增加,则正反应是_____反应(选填“放热”或“吸热”)。
【答案】 正反应的活化能 降低 -198 0.025 1185 2 m+n 吸热
【解析】(1)根据图像可知图中E表示正反应的活化能,该反应通常用V2O5作催化剂,加V2O5会降低活化能,使图中B点降低;(2)已知lmol SO2(g)氧化为1molSO3(g)的△H=-99kJ·mol-1,图中生成2mol三氧化硫,则△H=-198kJ·mol-1;(3)反应速率之比是化学计量数之比,如果反应速率v(SO2)为0.05mol·L-1·min-1,则v(O2)=0.025mol·L-1·min-1;(4)己知单质硫的燃烧热为296 kJ·mol-1,即①S(s)+O2(g)=SO2(g),又因为②2SO2(g)+O2(g)![]() 2SO3(g)△H=-198kJ·mol-1,根据盖斯定律可知①+②/2即得到S(s)+3/2O2(g)=SO3(g)△H=-395kJ·mol-1,所以由S(s)生成3molSO3(g)放热3mol×395kJ·mol-1=1185kJ;(5)5min后测得c(D)=0.5 mol·L-1,则用D表示的反应速率是0.5mol/L÷5min=0.1mol·L-1·min-1,又因为C的反应速率是0.1 mol·L-1·min-1,根据反应速率之比是相应的化学计量数之比可知x=2;(6)①A、B、C都是气体,减少压强,平衡向正反应方向移动,正反应体积增大,则m+n<p;②加热后,可使C的质量增加,则正反应是吸热反应。
2SO3(g)△H=-198kJ·mol-1,根据盖斯定律可知①+②/2即得到S(s)+3/2O2(g)=SO3(g)△H=-395kJ·mol-1,所以由S(s)生成3molSO3(g)放热3mol×395kJ·mol-1=1185kJ;(5)5min后测得c(D)=0.5 mol·L-1,则用D表示的反应速率是0.5mol/L÷5min=0.1mol·L-1·min-1,又因为C的反应速率是0.1 mol·L-1·min-1,根据反应速率之比是相应的化学计量数之比可知x=2;(6)①A、B、C都是气体,减少压强,平衡向正反应方向移动,正反应体积增大,则m+n<p;②加热后,可使C的质量增加,则正反应是吸热反应。


科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列说法正确的是( )
A. 石油的分馏和煤的液化都是物理变化
B. 聚乙烯塑料的老化是因为发生了加成反应
C. 沼气是可再生能源,电能是二次能源
D. 煤中含有苯、甲苯、二甲苯等芳香烃,可通过干馏制取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代《天工开物》中记载:“凡铸钱每十斤,红铜居六七,倭铅(锌的古称)居三四。”下列金属的冶炼原理与倭铅相同的是( )
A. Na B. Ag C. Mg D. Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于SO2的叙述,正确的是( )
A. 它可使石蕊试液褪色
B. 它与水作用生成H2SO4
C. 它能与BaCl2溶液反应生成BaSO3沉淀
D. 等物质的量的Cl2和SO2通入品红溶液中,品红溶液不褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性活动小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O,经测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是( )
NH4HCO3+NH3·H2O,经测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是( )

A. 0~12 min,初始浓度越大的实验,水解反应速率越大
B. c(NH2COO-)将随反应时间的不断延长而一直减小至0
C. 15 ℃时,第30 min时,c(NH2COO-)为2.0 mol·L-1
D. 25 ℃时0~6 min,v(NH2COO-)为0. 05 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示在不同条件下的酶促反应速率变化曲线。据图分析叙述错误的是( )
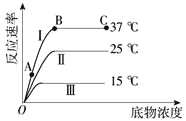
A. 影响AB段反应速率的主要因素是底物浓度
B. 影响BC段反应速率的主要限制因素可能是酶量
C. 温度导致了曲线Ⅰ和Ⅱ的反应速率不同
D. 曲线Ⅰ显示,该酶促反应的最适温度为37 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀HNO3与6.4g Cu恰好完全反应。若还原产物只有NO,则这些酸最多可溶解铁( )
A. 0.23mol B. 0.1mol C. 3.37g D. 8.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用图所示的实验装置测定Na2O2试样的纯度。(可供选用的试剂只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)

回答下列问题:
(1)装置A中液体试剂选用____________,理由是__________________________。
(2)装置B的作用是______________,装置E中碱石灰的作用是__________________。
(3)装置D中发生反应的化学方程式是:
_______________________、_______________________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com