
【题目】传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高,DIS数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量溶液的pH等而在中和滴定的研究中应用越来越广泛深入。

(1)田老师利用DIS系统探究强碱和不同酸的中和反应,实验过程如下:
Ⅰ.分别配制0.1000mol/L的NaOH、HCl、CH3COOH溶液备用。
Ⅱ.用0.1000mol/L的NaOH溶液分别滴定10.00mL0.1000mol/L的HCl和CH3COOH溶液,连接数据采集器和pH传感器。
Ⅲ.由计算机绘制的滴定曲线如图一:
①A是_____;
②两曲线图中V1_____V2 (填“>”、“=”或“<”),A点和B点,水的电离程度相比_________(填“A大”、“B大”、“一样大”或“无法判断”)。
(2)程老师利用DIS系统测定某醋酸溶液的物质的量浓度,以测量溶液导电能力来判断滴定终点,实验步骤如下:用_____(填仪器名称)量取20.00mL醋酸溶液样品,倒入洁净干燥锥形瓶中,连接好DIS系统,如果锥形瓶中含有少量蒸馏水,是否会影响测量结果_____(填“是”、“否”或“不能确定”),向锥形瓶中滴加0.1000mol/L的NaOH溶液,计算机屏幕上显示出溶液导电能力与加入NaOH溶液体积关系的曲线图(见图二)。
①图中b点时,![]() _______mol/L
_______mol/L
②若图中某一点pH等于8,则c(Na+)﹣c(CH3COO﹣)的精确值为_____ mol/L。
【答案】盐酸 > 一样大 酸式滴定管 否 0.05 9.9×10﹣7
【解析】
①根据图像得出开始为滴定时,A图pH值等于1。
②用假设法分析,假设等于10mL,溶液显酸碱性来分析,A点溶质为NaCl,不水解,B点溶质为醋酸和醋酸钠,呈中性说明醋酸抑制水的电离的程度与醋酸钠促进水的电离的程度相当。
⑵醋酸显酸性,根据量取20.00mL选用仪器,锥形瓶中含有少量蒸馏水,溶质物质的量未变;①根据图中b点,得出醋酸和氢氧化钠两者恰好完全应完,则消耗10mL氢氧化钠,混合后溶液的体积为20mL,溶质为醋酸钠,根据物料守恒和溶液体积变为二倍分析得出;②若图中某一点pH等于8,根据电荷守恒变形得到计算值。
①根据图像得出开始为滴定时,A图pH值等于1,说明是盐酸,故答案为:盐酸。
②pH =7,则盐酸消耗得氢氧化钠体积为10mL,而如果加入10mL到醋酸中,则恰好反应生成醋酸钠,溶液显碱性,而这需要呈中性,说明碱滴加过量,因此体积要小于10mL,即两曲线图中V1>V2,A点溶质为NaCl,强酸强碱盐,不水解,B点溶质为醋酸和醋酸钠,醋酸抑制水的电离,醋酸钠促进水的电离,而溶液呈中性,醋酸抑制水的电离程度和醋酸钠促进水的电离程度相等,两者抵消,因此对水的电离无影响,因此水的电离程度相比一样大;故答案为:>;一样大。
⑵醋酸显酸性,量取20.00mL,从数据看只能用酸式滴定管量取醋酸溶液样品,倒入洁净干燥锥形瓶中,如果锥形瓶中含有少量蒸馏水,溶质物质的量不变,因此不会影响测量结果,故答案为:酸式滴定管;否。
①根据图中b点,得出醋酸和氢氧化钠两者恰好完全应完,则消耗10mL氢氧化钠,混合后溶液的体积为20mL,溶质为醋酸钠,根据物料守恒得到![]() c(Na+) =
c(Na+) = ![]() ;故答案为:0.05。
;故答案为:0.05。
②若图中某一点pH等于8,根据电荷守恒变形得到c(Na+)c(CH3COO-)= c(OH-)c(H+)=1×106 mol·L11×108 mol·L1=9.9×107 mol·L1;故答案为:9.9×107。


科目:高中化学 来源: 题型:
【题目】在标准状况下,由甲烷、甲醛(HCHO)和乙烷组成的11.2升的混合气体完全燃烧后,生成0.7mol的二氧化碳气体。则混合气体中乙烷的体积分数为( )
A. 20%B. 40%C. 60%D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由W、X、Y、Z四种短周期元素组成化合物如图。其中W、Y、Z分别位于三个不同周期,Y核外最外层电子数是W核外最外层电子数的二倍,W、X、Y三种简单离子的核外电子排布相同。下列说法不正确的是
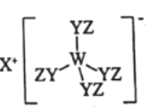
A.原子半径:W>X>Y>Z
B.常温常压下熔点:W2Y3>X2Y>Z2Y
C.X与Y、Y与Z均可形成具有漂白性的化合物
D.W与X的最高价氧化物的水化物可相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液中的离子平衡是中学学习的一个重要内容。
(1)下列溶液①0.1mol/L盐酸②0.1mol/L H2SO4溶液③0.1mol/LCH3COONa溶液④0.1mol/LNH4Cl溶液⑤0.1mol/L氨水,按pH由小到大顺序为_________________(填序号)
(2)等浓度的盐酸、氨水中,由水电离出的H+浓度c(H+)盐酸_________ c(H+)氨水(填“大于”“小于”或“等于”)。在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合充分反应后溶液呈中性。则反应后溶液存在的离子浓度由大到小顺序为_________,氨水的浓度a_______0.01 mol·L-1(填“>”、“<”或“=”)
(3)某同学查阅资料发现,人体血液里存在重要的酸碱平衡:CO2+H2OH2CO3![]() HCO3﹣,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。
HCO3﹣,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。
①人体血液酸中毒时,可注射_____(填选项)缓解;
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
②已知25℃时,![]() 水解反应的一级平衡常数
水解反应的一级平衡常数![]() ,当溶液中
,当溶液中![]() 时,溶液的pH=_________________。
时,溶液的pH=_________________。
(4)25℃时,AgCl的Ksp=1.8×10﹣10,该温度下向1 L 0.03 mol/L的AgNO3溶液中加入1 L 0.01 mol/L的NaCl溶液之后,溶液中c(Cl﹣)=_____mol/L(忽略混合前后溶液体积的变化)。平衡后,若向该体系中加入少量AgCl固体,则c(Cl﹣)_____(填“增大”或“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奥司他韦是一种高效、高选择性神经氨酸酶抑制剂,是目前治疗流感的最常用药物之一,是公认的抗禽流感、甲型H1N1等病毒最有效的药物之一也是国家的战略储备药物。也有专家尝试使用奥司他韦作为抗新型冠状病毒肺炎药物。下列说法正确的是( )

A.不能使酸性高锰酸钾溶液褪色
B.奥司他韦属于芳香族化合物
C.分子中所有碳原子共平面
D.可以发生加成反应、加聚反应、氧化反应、取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国部分地区水资源缺乏,海水淡化是永恒的话题。下列有关海水淡化的说法错误的是
A.如图制备蒸馏水方法技术成熟,但是成本太高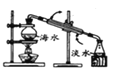
B.如图制备蒸馏水的过程,利用了清洁能源太阳能,且可分离出海水中的盐类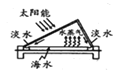
C.如图是离子交换法制备淡水,在阴阳离子交换后发生了酸碱中和反应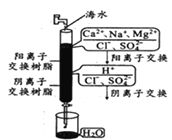
D.如图在阳离子交换过程中阳离子数目保持不变,溶液酸碱性也保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.100 mol/L盐酸溶液滴定25.00 mL 0.100 mol/L的氨水溶液,滴定曲线如图所示,下列有关说法不正确的是

A.可用甲基橙指示剂
B.a点所示溶液中,c(NH4+)>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+)
C.水的电离程度b点所示溶液大于a点所示溶液
D.c点所示溶液中,c(Cl-)+2c(OH-)=2c(H+)-2c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10 mL 0.1 mol/LNaOH溶液中,逐滴加入10 mL浓度为c mol/L的HF稀溶液。已知 25℃时:①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-67.7 kJ/mol ②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol。请根据信息判断,下列说法中不正确的是
A.整个滴加过程中,水的电离程度不一定存在先增大后减小的变化趋势
B.将氢氟酸溶液温度由25℃升高到35℃时,HF的电离程度减小(不考虑挥发)
C.当c>0.1时,溶液中才有可能存在c(Na+)=c(F-)
D.若滴定过程中存在:c(Na+)>c(OH-)>c(F-)>c(H+),则c一定小于0.1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com