
【题目】已知:A、B、C均是由短周期元素组成的单质,其余物质均为化合物.F在常温常压下为液态,I为具有磁性的黑色晶体.它们有下图所示的转化关系: 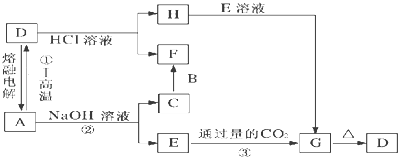
根据以上转换关系回答:
(1)写出反应①的化学方程式:;
(2)写出反应②的离子方程式:;写出H+E反应的离子方程式:;
(3)将I溶于足量盐酸,请分别写出反应后混合溶液中存在的阳离子、检验所需试剂及相应现象(可不填满):
阳离子 | 检验试剂 |
【答案】
(1)8Al+3Fe3O4 ![]() 9Fe+4Al2O3
9Fe+4Al2O3
(2)2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;Al3++3AlO2﹣+6H2O═4Al(OH)3↓
(3)H+;石蕊试液;Fe3+;KSCN溶液;Fe2+;K3[Fe(CN)6]
【解析】解:A、B、C均是由短周期元素组成的单质,D、E、F、G、H、I均为化合物,F在常温常压下为液态,由D与盐酸反应得到,可以推断F为H2O,I为具有磁性的黑色晶体,为Fe3O4 , 由A与D相互转化及D能与氢氧化钠溶液反应,可知A为Al、D为Al2O3 , 结合转化关系,可推知C为H2、E为NaAlO2、G为Al(OH)3、B为O2、H为AlCl3 , (1)反应①的化学方程式为:8Al+3Fe3O4 ![]() 9Fe+4Al2O3 , 所以答案是:8Al+3Fe3O4
9Fe+4Al2O3 , 所以答案是:8Al+3Fe3O4 ![]() 9Fe+4Al2O3;(2)反应②的离子方程式为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;H为AlCl3 , E为NaAlO2 , H+E反应的离子方程式为:Al3++3AlO2﹣+6H2O═4Al(OH)3↓,所以答案是:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;Al3++3AlO2﹣+6H2O═4Al(OH)3↓;(3)将Fe3O4溶于足量盐酸生成氯化铁、氯化亚铁,所以溶液中存在的阳离子为H+、Fe3+、Fe2+、检验H+用石蕊试液,现象为溶液呈红色,检验Fe3+用KSCN溶液,现象为溶液出现血红色,检验Fe2+用K3[Fe(CN)6],现象为蓝色沉淀, 所以答案是:
9Fe+4Al2O3;(2)反应②的离子方程式为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;H为AlCl3 , E为NaAlO2 , H+E反应的离子方程式为:Al3++3AlO2﹣+6H2O═4Al(OH)3↓,所以答案是:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;Al3++3AlO2﹣+6H2O═4Al(OH)3↓;(3)将Fe3O4溶于足量盐酸生成氯化铁、氯化亚铁,所以溶液中存在的阳离子为H+、Fe3+、Fe2+、检验H+用石蕊试液,现象为溶液呈红色,检验Fe3+用KSCN溶液,现象为溶液出现血红色,检验Fe2+用K3[Fe(CN)6],现象为蓝色沉淀, 所以答案是:
阳离子 | 检验试剂 |
H+ | 石蕊试液等 |
Fe3+ | KSCN溶液等 |
Fe2+ | K3[Fe(CN)6] |
;


科目:高中化学 来源: 题型:
【题目】铬、钛及其化合物在工业上有重要用途,回答下列问题:
(1)Cr基态原子价层电子的轨道表达式(电子排布图)为_________________________。
(2)氮化铬(CrN)在超级电容器领域具有良好的应用前景,可由CrCl3·6H2O与尿素[(NH2)2CO]反应先得到配合物Cr[OC(NH2)2]6Cl3,然后在通有NH3和N2混合气体的反应炉内热分解制得。尿素构成元素中电负性由大到小的顺序为_________,中心碳原子的杂化类型为_________;Cr[OC(NH2)2]6Cl3含有的化学键类型有__________________。
(3)氮化铬的晶体结构类型与氯化钠的相同,氮化铬熔点(1282℃)比氯化钠的高,主要原因是_________________________________________。
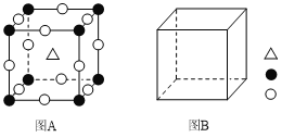
(4)钙钛矿(CaTiO3)型的结构可看作氧化物超导相结构的基本单元。
①图A为立方钙钛矿(CaTiO3)结构的晶胞,晶胞边长为a nm。Ca处于晶胞的顶点,则Ti处于_________位置,O处于_________位置;与Ca紧邻的O个数为_________,Ti与O间的最短距离为____________________nm 。
②在图B中画出立方钙钛矿晶胞结构的另一种表示(要求:Ti处于晶胞的顶点;![]() ,
,![]() ,
,![]() 所代表的原子种类与图A相同)____________________。
所代表的原子种类与图A相同)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
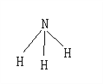
【题目】已知断裂1molH-H要吸收的能量为436kJ,形成1molH-N放出391kJ的能量,氨气的结构如图,根据化学方程式N2+3H2 ![]() 2NH3,1molN2与3molH2反应时放热92kJ,则断裂1molN≡N所需要的能量为 ( )
2NH3,1molN2与3molH2反应时放热92kJ,则断裂1molN≡N所需要的能量为 ( )
A. 431kJ B. 698kJ C. 946kJ D. 394kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A固体中仅含两种元素,其中金属元素的质量分数约为46.7%. 
(1)A的化学式为; F的化学式为;
(2)反应③的化学方程式:;
(3)反应②的离子方程式:;
(4)反应④的离子方程式:;
(5)已知每生成16g E,放出106.5kJ热量,则反应①的热化学方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项正确的是
A. 25℃时,AgBr在0.01mol/L的MgBr2溶液和NaBr溶液中的溶解度相同
B. NaCN溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(HCN)
C. 25℃时,将0.01mol/L的醋酸溶液加水不断稀释,  减小
减小
D. Na2CO3、NaHCO3溶液等浓度等体积混合后: 3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液体积比是( )
A.1:9
B.1:1
C.1:2
D.1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产、生活中有着广泛的应用。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体,同时得到浅绿色酸性溶液。为此,他们设计了如下装置验证所产生的气体(夹持装置省略)并进行有关实验。

(1)①若装置A中的试管不加热,则没有明显现象,原因是____________。
②证明有SO2 生成的现象是_____;为了证明气体中含有氢气,装置B和C中加入的试剂分别为X、CuSO4,请写出装置B处反应的化学方程式________________。
(2)取装置A试管中的溶液6mL,加入适量氯水恰好反应,再加入过量的KI溶液后,分别取2mL此溶液于3支小试管中进行如下实验:
①第一支试管中加入1mLCCl4,充分振荡、静置,CCl4层呈紫色;
②第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是________________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有____(填离子符号),由此可以证明该离子与I-发生的氧化还原反应为_______。
(3)向盛有H202溶液的试管中加入几滴装置A试管中的溶液,溶液变成棕黄色,发生反应的离子方程式为_________________;一段时间后,溶液中有气泡出现并放热,随后有红褐色沉淀生成。产生气泡的原因是________________;生成沉淀的原因是_______________ (用平衡移动原理解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的叙述中正确的是
A.正极和负极必须是两种不同的金属
B.电子流入的一极为正极
C.原电池工作时,正极和负极上发生的都是氧化还原反应
D.原电池工作时,实现了将电能转化为化学能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com