
【题目】40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如图所示.下列说法不正确的是( )
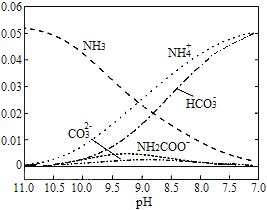
A. 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-)
B. 不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)
C. 随着CO2的通入,![]() 不断增大
不断增大
D. 在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成
【答案】C
【解析】试题分析:A.pH=9时,图象中各种离子浓度的大小关系:c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-),故A正确;B.溶液中存在电荷守恒,即正电荷的总浓度等于负电荷的总浓度,则不同pH的溶液中存在电荷守恒关系为:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-),故B正确;C.已知Kb= ,温度一定时,Kb为常数,不随浓度的变化而变化,随着CO2的通入,c(NH4+)逐渐增大,则
,温度一定时,Kb为常数,不随浓度的变化而变化,随着CO2的通入,c(NH4+)逐渐增大,则![]() 不断减小,故C错误;D.由图象可知开始没有NH2COO-,后来也不存在NH2COO-,所以NH2COO-为中间产物,即在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成,故D正确,故选C。
不断减小,故C错误;D.由图象可知开始没有NH2COO-,后来也不存在NH2COO-,所以NH2COO-为中间产物,即在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成,故D正确,故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数,下列说法正确的是
A. 0.5 mol Al与足量盐酸反应转移电子数为1NA
B. 标准状况下,11.2 L SO3所含的分子数为0.5NA
C. 0.1 mol CH4所含的电子数为1NA
D. 46 g NO2和 N2O4的混合物含有的分子数为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室现有3种酸碱指示剂,其pH变色范围如下
甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0
用0.100 0 mol·L-1 NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是( )
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2Cl2是工业上常用的硫化剂,已知S2C12中硫元素显+1价,它不稳定,在水中易发生岐化反应,易溶于有机溶剂。实验室常用CS2与纯净的氯气制备S2C12。反应涉及到的几种物质的熔沸点如下:
物质 | CS2 | Cl2 | CCl4 | S2C12 |
沸点/℃ | 47 | -34.6℃ | 77 | 137 |
熔点/℃ | -109 | -100.98℃ | -23 | -77 |
实验室利用下列装置制备S2C12 (部分夹持仪器己略去):
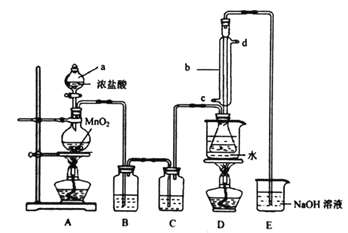
回答下列问题:
(1)装置中b玻璃仪器的名称为_______;写出制备S2C12的化学方程式_______。
(2)整套装置装配完毕后,首先进行的操作是________,再添加试剂。
(3)实验中盐酸试剂通常采用36.5%的浓盐酸,不用稀盐酸的理由是________。
装置A中反应的离子方程式是___________。
(4) D中采用热水浴加热的原因是__________,反应结束后从锥形瓶内混合物中分离出产品的方法是_______________。
(5)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因化学方程式表示为__________。
(6)该实始装置设计存在缺陷,你的改进建议及改进目的是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碱金属元素的说法正确的是( )
A. 锂与过量氧气反应,生成过氧化锂
B. 从锂到铯,密度由小到大
C. 从锂到铯,熔沸点依次升高
D. 钠与水反应不如钾与水反应剧烈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述正确的是
A. 聚乙烯塑料中含有大量碳碳双键,容易老化
B. 苯、油脂均不能使酸性KMnO4溶液褪色
C. 甲苯苯环上的一个氢原子被一C3H6Cl取代,形成的同分异构体有9种
D. CH2=CHCH2OH能发生加成反应、取代反应、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,进行如下反应:C(s)+H2O(g) ![]() CO(g)+H2(g)
CO(g)+H2(g)
(1)若容器体积为2L,反应l0s氢气质量增加0.4g,则该时间内一氧化碳的反应速率为_______mol/(L.s)。若增加炭的量,则正反应速率_______。(选填“增大”、“减小”、不变)若增大压强,化学平衡向____移动。(选填“正向”、“逆向”或“不”)
(2)该反应达到平衡状态的标志是______。(选填编号)
A.压强不变 B.v正(H2)=V正(H2O) C.c(CO)不变 D.c(H2O)=c(CO)
(3)若升高温度,平衡向正向移动,则正反应是_______反应。(选填“吸热”或“放热”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com