
【题目】用NA代表阿伏加德罗常数,下列说法正确的是
A. 0.5 mol Al与足量盐酸反应转移电子数为1NA
B. 标准状况下,11.2 L SO3所含的分子数为0.5NA
C. 0.1 mol CH4所含的电子数为1NA
D. 46 g NO2和 N2O4的混合物含有的分子数为1NA
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】镁、铁组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48 L,下列推断中错误的是
A. 参加反应的镁、铁共0.2 mol
B. 参加反应的盐酸为0.2 mol
C. 镁、铁在反应中共失去电子0.4 mol
D. 若与足量的稀硫酸反应能产生氢气0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B为两种主族元素,A2-与B3+具有相同的电子层结构。下列有关说法正确的是
A. 原子半径:A>B B. 离子半径:A2->B3+ C. 原子序数:A>B D. A 、B 可形成化合物A2B3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可按下面框图进行反应。又知E溶液是无色的。
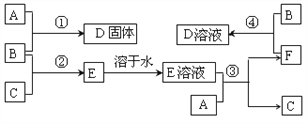
请回答:
(1)A是____________,B是____________,C是_____________。(填化学式)
(2)反应①的化学方程式为________________________________________
(3)反应③的化学方程式为________________________________________
(4)反应④的化学方程式为________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为探究元素周期表中元素性质的递变规律,设计了如下实验。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:________与盐酸反应最剧烈,________与盐酸反应的速度最慢;________与盐酸反应产生的气体最多。
向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_______________。
(3)资料显示:钠、镁、铝都可以用于制备储氢的金属氢化物。
① NaH是离子化合物,能与水发生氧化还原反应生成H2,该反应的还原剂是________________。
② NaAlH4是一种良好的储氢材料。NaAlH4与水反应产生氢气的化学方程式为____________________。
Ⅱ.为验证氯、溴、碘三种元素的非金属性强弱,用下图所示装置进行试验(夹持仪器已略去,气密性已检验)。

实验过程:
①打开弹簧夹,打开活塞a,滴加浓盐酸。
②当B和C中的溶液都变为黄色时,夹紧弹簧夹。
③当B中溶液由黄色变为棕红色时,关闭活塞a。
④……
(1)A中发生反应生成氯气,请写出该反应的离子方程式:___________________。
(2)验证氯气的氧化性强于碘的实验现象是________________________。
(3)B、C管口“浸有NaOH溶液的棉花”的作用是__________________________。
(4)为验证溴的氧化性强于碘,过程④的操作和现象是______________________。
(5)过程③实验的目的是____________________。
(6)请运用原子结构理论解释氯、溴、碘非金属性逐渐减弱的原因:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为______________,A电极的电极反应式为 ;反应进行一段时间后溶液C的pH将 (填“升高”“降低”或“基本不变”)。
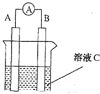
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是________,负极反应为___________;正极反应为_______________________。
(3)熔盐电池具有高的发电效率,因而受到重视, 可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32-4e-=4CO2,正极反应式为________________________,电池总反应式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫常温下为无色有刺激性气味的有毒气体,易液化,易溶于水。某同学设计如下实验方案,对二氧化硫的化学性质进行探究,装置如下图所示。请回答下列问题:

(1)反应结束时烧瓶中Cu由剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量。经冷却,定量稀释后进行下列实验,能达到的目的是 (填序号)
a.用酸碱中和滴定法测定
b.与足量Zn反应,测量生成H2的体积
c.用pH计测溶液PH值
d.与足量BaCl2溶液反应,称量生成沉淀的质量
(2)装置B的作用是 ,设计装置C的目的是验证SO2的 性,装置C中发生反应的离子方程式 ,装置D中NaOH全部转化为NaHSO3的标志是____________
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能情况:
I.HSO3-与ClO-刚好反应完; Ⅱ.NaClO不足; Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:(已知酸性:H2SO3>H2CO3>HClO)
实验序号 | 实验操作 | 现象 | 反应的可能情况 |
① | 加入几小块CaCO3固体 | 有气泡产生 | |
② | 滴加少量淀粉KI溶液,振荡 | Ⅲ | |
③ | 滴加少量溴水,振荡 | Ⅱ | |
④ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液为紫色 |
(4)设计简单实验证明:室温下HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验操作的叙述中正确的是( )
A. 从试剂瓶中取出任何药品,若有剩余一定不能再放回原试剂瓶中
B. 可燃性气体点燃之前必须验纯
C. 用胶头滴管向试管中滴加液体,一定要将滴管伸入试管内
D. 用温度计搅拌溶液一定要慢慢搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如图所示.下列说法不正确的是( )
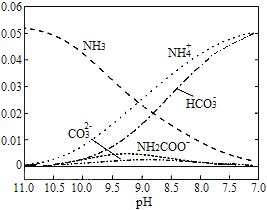
A. 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-)
B. 不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)
C. 随着CO2的通入,![]() 不断增大
不断增大
D. 在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com