
【题目】某研究小组为探究元素周期表中元素性质的递变规律,设计了如下实验。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:________与盐酸反应最剧烈,________与盐酸反应的速度最慢;________与盐酸反应产生的气体最多。
向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_______________。
(3)资料显示:钠、镁、铝都可以用于制备储氢的金属氢化物。
① NaH是离子化合物,能与水发生氧化还原反应生成H2,该反应的还原剂是________________。
② NaAlH4是一种良好的储氢材料。NaAlH4与水反应产生氢气的化学方程式为____________________。
Ⅱ.为验证氯、溴、碘三种元素的非金属性强弱,用下图所示装置进行试验(夹持仪器已略去,气密性已检验)。

实验过程:
①打开弹簧夹,打开活塞a,滴加浓盐酸。
②当B和C中的溶液都变为黄色时,夹紧弹簧夹。
③当B中溶液由黄色变为棕红色时,关闭活塞a。
④……
(1)A中发生反应生成氯气,请写出该反应的离子方程式:___________________。
(2)验证氯气的氧化性强于碘的实验现象是________________________。
(3)B、C管口“浸有NaOH溶液的棉花”的作用是__________________________。
(4)为验证溴的氧化性强于碘,过程④的操作和现象是______________________。
(5)过程③实验的目的是____________________。
(6)请运用原子结构理论解释氯、溴、碘非金属性逐渐减弱的原因:_______________。
【答案】 钾 铝 铝 S2-+Cl2 == S↓+2Cl- NaH NaAlH4+2H2O=NaAlO2+4H2↑ 2MnO4-+16H++10Cl-== 2Mn2++5Cl2↑+8H2O 淀粉KI试纸变蓝 吸收氯气 防止污染 打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡。静止后CCl4层溶液变为紫红色 确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰 同主族元素从上到下,原子半径逐渐增大,得电子能力逐渐减弱
【解析】Ⅰ.(1)金属活泼性顺序为:钾>钠>镁>铝,所以相同条件下与盐酸反应最激烈的是钾,反应速率最慢的是铝;生成1mol氢气需要得到2mol电子,1mol钾、钠都失去1mol电子,1mol镁失去2mol电子,而1mol铝失去3mol电子,所以生成氢气最多的是金属铝;(2)氯气氧化性强于硫单质,所以氯气能够与硫离子反应生成硫,反应的离子方程式为:S2-+Cl2═S↓+2Cl-;(3)① NaH和水反应的方程式为:NaH+H2O=NaOH+H2↑,其中水是氧化剂,NaH是还原剂;由上述反应不难发现NaAlH4中的H呈-1价,同样可以被水氧化为氢气,同时生成NaAlO2,即:NaAlH4+2H2O=NaAlO2+4H2↑;
Ⅱ.(1)A中高锰酸钾与浓盐酸反应生成氯气、氯化钾、氯化锰和水的离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;(2)验证氯气的氧化性强于碘的实验现象是KI淀粉试纸变蓝,Cl2+2I-=2Cl-+I2 ,I2遇淀粉变蓝色;(3)B、C管口“浸有NaOH溶液的棉花”的作用是:吸收氯气,防止污染空气;(4)为验证溴的氧化性强于碘,过程④的操作和现象是打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡。静止后CCl4层溶液变为紫红色,其中紫红色为I2溶解在CCl4呈现的颜色;(5)过程③实验的目的是确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰;(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,原子半径逐渐增大,得电子能力逐渐减弱。


科目:高中化学 来源: 题型:
【题目】改革开放以来,人民生活水平不断提高,更加讲究合理膳食。下列饮食习惯科学的是
A.多吃肉,少吃蔬菜水果 B.多饮纯净水,少饮矿泉水
C.多食用含防腐剂的食品 D.注意饮食的合理搭配
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2+NH4Cl═NaCl+N2+2H2O.下列关于该反应的说法中,正确的是( )
A. NH4Cl中的N元素被还原
B. 生成1 mol N2时转移的电子数为6 mol
C. NaNO2是氧化剂
D. N2既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)可作还原剂、着色剂、制药等,在不同温度下易分解得各种铁的氧化物和硫的氧化物。已知SO3是一种无色晶体,熔点16.8℃,沸点44.8℃,氧化性及脱水性较浓硫酸强,能漂白某些有机染料,如品红等。回答下列问题:
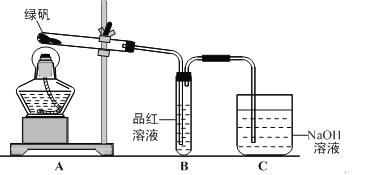
甲组同学按照上图所示的装置,通过实验检验绿矾的分解产物。装置B中可观察到的现象是___________,甲组由此得出绿矾的分解产物中含有SO2。装置C的作用是__________________。
(2)乙组同学认为甲组同学的实验结论不严谨,认为需要补做实验。乙对甲组同学做完实验的B装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中_____________。(填字母)
A.不含SO2 B.可能含SO2 C.一定含有SO3
(3)丙组同学查阅资料发现绿矾受热分解还可能有O2放出,为此,丙组同学选用甲组同学的部分装置和下图部分装置设计出了一套检验绿矾分解气态产物的装置:
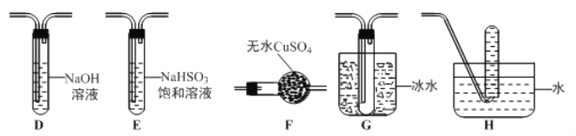
①丙组同学的实验装置中,依次连接的合理顺序为 _______________。
②能证明绿矾分解产物中有O2的实验操作及现象是_______________ 。
(4)为证明绿矾分解产物中含有三价铁,选用的实验仪器有试管、胶头滴管、_______________;选用的试剂为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是周期表中短周期的一部分。若X原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )

A. 原子半径的大小顺序是Z>Y>X>W
B. Z的气态氢化物比X的气态氢化物稳定
C. X、Y、Z各元素最高价和最低价的绝对值之和为8
D. X、Y、Z最高价氧化物对应水化物的酸性强弱关系Z>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于F、Cl、Br、I性质的比较,不正确的是( )
A.单质的颜色随核电荷数的增加而加深
B.单质的熔、沸点随核电荷数的增加而升高
C.单质的氧化性减弱
D.它们的氢化物的稳定性随核电荷数的增加而增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如下图所示。则下列离子组在对应的溶液中,一定能大量共存的是( )
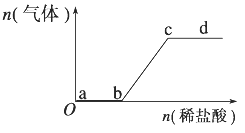
A. a点对应的溶液中:Na+、OH-、SO![]() 、NO
、NO![]()
B. b点对应的溶液中:Al3+、Fe3+、MnO![]() 、Cl-
、Cl-
C. c点对应的溶液中:Na+、Ca2+、NO![]() 、Cl-
、Cl-
D. d点对应的溶液中:F-、NO![]() 、Fe3+、Ag+
、Fe3+、Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四个集气瓶中分别充满了Cl2、O2、H2、HCl四种气体中的一种。A瓶中的气体是黄绿色;C和A中的气体混合见光会爆炸;将D瓶的瓶盖打开,在潮湿空气中会出现白雾。根据以上现象判断各瓶中的气体分别是: A.;B.;C.;D.。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )
A.9.0 L B.13.5 L C.15.7 L D.16.8 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com