
【题目】已知H2(g)、CO(g)、CH3OH(l)的燃烧热![]() H分别是-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。下列有关叙述正确的是( )
H分别是-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。下列有关叙述正确的是( )
A.甲醇不完全燃烧生成CO和液态水的热化学方程式:
CH3OH(l)+O2 (g)== CO(g)+2H2O(l) △H1=-1009.5kJ·mol-1
B.CH3OH(l)+1/2O2 (g)== CO2(g)+2H2 (g) △H1=-440.7kJ·mol-1
C.2H2O(g) == 2H2(g)+O2(g) △H1 =+571.6 kJ·mol-1
D.已知:S(s)+O2(g) = SO2(g) △H1 ;S(g)+O2(g) = SO2(g) △H2 ;则△H1>△H2
【答案】D
【解析】
试题分析:A、由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJmol-1和-726.5kJmol-1,则
①CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJmol-1
②CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-726.5kJmol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),
该反应的反应热△H=-726.5kJmol-1-(-283.0kJmol-1)=-443.5kJmol-1,
即为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJmol-1,A错误;
B、H2(g)的燃烧热△H为-285.8 kJ·mol-1,则③H2(g)+1/2O2(g)= H2O(l)△H=-285.8kJmol-1,则根据盖斯定律可知②-③×2即得到CH3OH(l)+1/2O2 (g)=CO2(g)+2H2 (g) △H1=-154.9kJ·mol-1,B错误;C、根据氢气的燃烧热可知2H2O(l)=2H2(g)+O2(g) △H1=+571.6 kJ·mol-1,C错误;D、S燃烧为放热反应,1mol气体S具有的能量必1mol固态S高,因此1mol气态S燃烧放热多,焓变小,即为△H1>△H2,D正确;答案选D。


科目:高中化学 来源: 题型:
【题目】下列反应可用于合成CH3OH:
![]()
(1)Mn2+基态核外电子排布式为____________。
(2)与NO3-互为等电子体的分子为_______(写化学式)。
(3)CO32-的空间构型是________(用文字描述)。
(4)1molCH3OH中含有σ键的数目为______mol。CH3OH与H2O可以任意比互溶,除因为它们都是极性分子外,还因为________。
(5)锰元素的一种硫化物晶体的晶胞结构如图所示,该硫化物的化学式为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是指粒子直径在几纳米到几十纳米的材料.如将“纳米材料”分散到液体分散剂中,所得分散系的有关说法正确的是( )
A.是纯净物
B.所得物质一定为悬浊液或乳浊液
C.能通过过滤的方法得到纳米材料
D.有丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2·H2O也是一元弱碱,25℃时电离常Kb=4.0×10-5。现用0.0500mol/L的稀硫酸滴定10mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示。下列说法正确的是
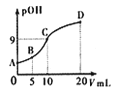
A. 甲胺在水中的电离方程式为:CH3NH2·H2O=CH3NH3++OH-
B. A、B、C三点溶液中,水电离出来的c(H+):B>C>A
C. C点所在溶液中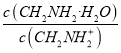 =2.5×10-5
=2.5×10-5
D. B点溶液中存在c(CH3NH2·H2O)>c(CH3NH3+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于消去反应的是
A. 乙醇与浓硫酸共热到140℃ B. 乙醇与氢溴酸(HBr)反应
C. 乙醇与氧气反应生成乙醛 D. 乙醇与浓硫酸共热至170℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列改变可确认化学平衡一定移动的是( )
A. 化学平衡常数发生了改变
B. 有气态物质参加的可逆反应达到平衡后,改变了压强
C. 正逆反应速率发生了改变
D. 有固态物质参加的可逆反应达到平衡后,移走适量的固态物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d是四种短周期元素,a、b、d同周期,c、d同主族。a的原子结构示意图为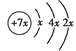 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为![]() 。下列比较中正确的是
。下列比较中正确的是
A. 原子半径:a>c>d>b B. 电负性:a>b>d>c
C. 原子序数:a>d>b>c D. 最高价含氧酸的酸性:c>d>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
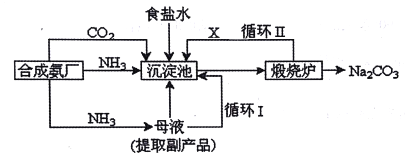
(1)沉淀池中发生的化学反应方程式是______。
(2)上述流程中X物质的分子式______。
(3)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是___(选填字母)。
A.碳酸氢钠难溶于水
B.碳酸氢钠受热易分解
C.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(4)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

请回答:
①甲中发生反应的离子方程式是________。
②乙装置中的试剂是___________。
③实验结束后,分离出NaHCO3晶体的操作是________(填分离操作的名称)。
第二位同学:用图中戊装置进行实验(其它装置未画出)。
④为提高二氧化碳在此反应液中被吸收的程度,实验时,须先从a管通入___气体,再从b管通入_____ 气体。
⑤装置c中的试剂为_______(选填字母)。
A.碱石灰 B.浓硫酸 C.无水氯化钙
(5)请你再写出一种实验室制取少量碳酸氢钠的方法:(用简要的文字和相关的化学反应方程式来描述):________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com