
【题目】下列反应可用于合成CH3OH:
![]()
(1)Mn2+基态核外电子排布式为____________。
(2)与NO3-互为等电子体的分子为_______(写化学式)。
(3)CO32-的空间构型是________(用文字描述)。
(4)1molCH3OH中含有σ键的数目为______mol。CH3OH与H2O可以任意比互溶,除因为它们都是极性分子外,还因为________。
(5)锰元素的一种硫化物晶体的晶胞结构如图所示,该硫化物的化学式为________。

【答案】 1s22s22p63s23p63d5或[Ar]3d5 SO2或BF3等 平面三角形 5 CH3OH与H2O分子之间可以形成氢键 MnS
【解析】 (1)Mn为25号元素,Mn2+基态核外电子排布式为1s22s22p63s23p63d5,故答案为:1s22s22p63s23p63d5;
(2)与NO3-互为等电子体的分子为SO2或BF3等,故答案为:SO2或BF3等;
(3)CO32-中C的经常带着对数=3+![]() ×(4+2-3×2)=3,采用sp2杂化,空间构型是平面三角形,故答案为:平面三角形;
×(4+2-3×2)=3,采用sp2杂化,空间构型是平面三角形,故答案为:平面三角形;
(4)1molCH3OH中含有σ键的数目为![]() ×(4+1×4+2)=5mol,CH3OH与H2O分子之间可以形成氢键,因此CH3OH与H2O可以任意比互溶,故答案为:5;CH3OH与H2O分子之间可以形成氢键;
×(4+1×4+2)=5mol,CH3OH与H2O分子之间可以形成氢键,因此CH3OH与H2O可以任意比互溶,故答案为:5;CH3OH与H2O分子之间可以形成氢键;
(5)根据该锰元素的硫化物晶体的晶胞结构,黑球的数目=12×![]() +1=4,白球的数目=8×
+1=4,白球的数目=8×![]() +6×
+6×![]() =4,数目之比为1:1,该硫化物的化学式为MnS,故答案为:MnS。
=4,数目之比为1:1,该硫化物的化学式为MnS,故答案为:MnS。


科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又是电动公交车的清洁能源,利用水煤气在一定条件下含成甲醇,发生的反应为:CO (g) +2H2(g)![]() CH3OH(l) △H=?
CH3OH(l) △H=?
(1)己知CO、H2、CH3OH的燃烧热分别为283.0kJ/mol,285.8kJ/mol,726.5kJ/mol 则△H=______。
(2)在一容积为2L的恒容密闭容器中加入0.2mol CO和0.4mol H2,发生如下反应:CO (g) +2H2(g)![]() CH3OH(g),实验测得T1℃和T2℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
CH3OH(g),实验测得T1℃和T2℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
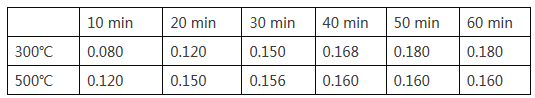
①由上述数据可以判断:T1℃_____T2℃
②T1℃时,0~20minH2的平均反应速率v(H2)=_________。
③该反应T1℃达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是_____(选填编号)。
A.改用高效催化剂 B.升高温度 C.缩小容器体积 D.分离出甲醇 E.增加CO的浓度
(3)若保持T1℃不变,起始时加入CO、H2、CH3OH的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,则a、b、c应该满足的条件___________。
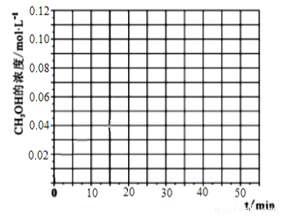
(4)当反应在T1℃达到20min时,控制体积不变,迅速将0.02molCO,0.04molH2,0.18molCH3OH同时投入体系中,后在恒压条件下,反应在40min时达到平衡,请在图中画出2040min内容器中 H2浓度的变化趋势曲线:___________
(5)在以CH3OH(l)为燃料的燃料电池中,电解质溶液为酸性,则负极的电极反应式为__________;理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______。(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应N2(g)+3H2(g) ![]() 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A . N2,H2的和NH3的质量分数不再改变
B.c(N2):c(H2):c(NH3)=1:3:2
C .N2和H2的物质的量之和NH3的物质的量的2倍
D. 单位时间内每增加1molN2,同时增加3molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
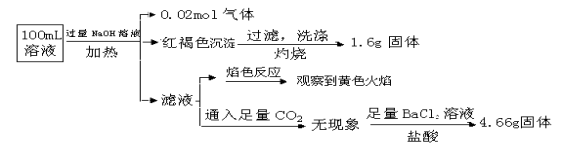
下列说法正确的是( )
A.原溶液中c(Fe3+)=0.2 mol·L-1
B.溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol·L-1
C.SO42ˉ、NH4+ 、Na+一定存在,CO32ˉ一定不存在
D.要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于H2S叙述不正确的是( )
A. H2S热稳定性差,在加热条件下会分解为硫单质与氢气
B. 部分金属硫化物不溶于酸,将硫化氢通入CuSO4、FeSO4等溶液中会出现黑色沉淀
C. H2S具有毒性,可以用湿润的醋酸铅试纸检验H2S
D. 久置的氢硫酸溶液易变质,是因为H2S具有很强的还原性,被空气中的O2氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析离子反应xR2++yH++O2=mR3++nH2O,下列说法中正确的是( )
A.n=2,H2O是氧化产物
B.x=y=m=4
C.该反应中R2+得到电子,被氧化为R3+
D.任何氧化还原反应中氧化剂失电子总数都等于还原剂得电子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、CO(g)、CH3OH(l)的燃烧热![]() H分别是-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。下列有关叙述正确的是( )
H分别是-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。下列有关叙述正确的是( )
A.甲醇不完全燃烧生成CO和液态水的热化学方程式:
CH3OH(l)+O2 (g)== CO(g)+2H2O(l) △H1=-1009.5kJ·mol-1
B.CH3OH(l)+1/2O2 (g)== CO2(g)+2H2 (g) △H1=-440.7kJ·mol-1
C.2H2O(g) == 2H2(g)+O2(g) △H1 =+571.6 kJ·mol-1
D.已知:S(s)+O2(g) = SO2(g) △H1 ;S(g)+O2(g) = SO2(g) △H2 ;则△H1>△H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com