
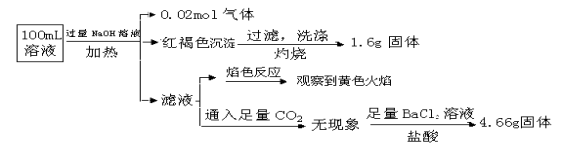
【题目】某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
下列说法正确的是( )
A.原溶液中c(Fe3+)=0.2 mol·L-1
B.溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol·L-1
C.SO42ˉ、NH4+ 、Na+一定存在,CO32ˉ一定不存在
D.要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+
【答案】B
【解析】
试题分析:①加入过量NaOH溶液,加热,得到0.02mol气体,说明有NH4+,而且为0.02mol。同时产生红褐色沉淀,说明有Fe3+,但由于Fe2+极易被氧化为Fe3+,所以这里不能排除原溶液中没有Fe2+存在,又由于Fe3+(或Fe2+)不能与CO32ˉ共存,所以原溶液中就没有CO32ˉ,且根据过滤、洗涤、灼烧后得1.6g固体(Fe2O3)可知Fe离子为0.02mol。②滤液焰色反应呈黄色,说明有Na+,但不能说明有原溶液中一定Na+,因为在加入过量NaOH溶液时,引入了Na+。③根据不溶于盐酸的4.66g沉淀,说明有SO42-,且为0.02mol。④根据电荷守恒可知一定有Cl-,且至少有0.02mol,因为如果原溶液中有Na+,则Cl-大于0.02mol,即c(Clˉ)≥0.2 mol·L-1。滤液中通入二氧化碳不产生沉淀,说明不存在铝离子。由此可知,原溶液中NH4+、SO42ˉ、Clˉ一定存在,Fe3+或Fe2+至少有一种存在;Na+可能存在也可能不存在;CO32ˉ、Al3+一定不存在,答案选B。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】某工厂用一固体废渣(主要成份为Al2O3·Cr2O3,还含有FeO、SiO2)为主要原料回收利用,生产红矾钠晶体(Na2Cr2O7·2H2O),同时制备明矾(KAl(SO4)2·12H2O)。其主要工艺流程如下:
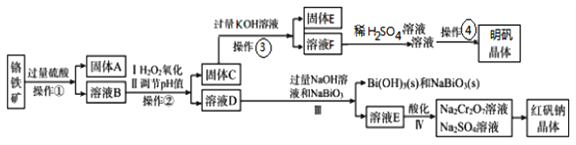
己知:NaBiO3不溶于冷水,在碱性条件下能将Cr3+氧化为CrO42-
(1)I、II目的是___________。
(2)实验室中操作④的名称为_______________。
(3)己知:Ksp[Fe(OH)3]=3.0×10-39,Ksp[Al(OH)3]=3×10-33。当pH=5.6时Cr(OH)3开始沉淀。室温下,II中需调节溶液pH范围为___________(杂质离子浓度小于1×10-6mol/L视为沉淀完全)。
(4)写出Ⅲ中发生反应的离子方程式_____________。
(5)IV中酸化是用硫酸而不用盐酸酸化,理由是_____________(结合化学方程式回答)。
(6)写出溶液F和硫酸溶液反应的离子方程式_________,若用足量二氧化碳通入F中,则生成的溶液中离子浓度关系为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作正确的是
A. 用pH试纸测得某新制氯水的pH值为3.5
B. 用酸式滴定管量取酸性高锰酸钾溶液5.10mL
C. 用标准盐酸溶液滴定一定体积的待测NaOH溶液时,用待测溶液润洗锥形瓶
D. 用l0 mL的量简量取8.05mL浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向饱和AgCl溶液中加水,下列叙述正确的是
A. AgCl的溶解度增大 B. AgCl的溶解度、Ksp均不变
C. AgCl的Ksp增大 D. AgCl的溶解度、Ksp均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1 000 mL,其pH与溶液体积的关系如图19,下列说法正确的是( )
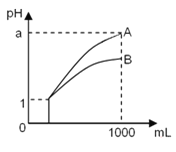
①若a<4,则A、B都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A.①④ B.②③ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)图1表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL, 如果刻度A为4,量简中液体的体积是__________mL。
(2)图II表示50mL滴定管中液画的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)________。
A. 是amL B.是(50-a)mL
C. 一定大于amL D.一定大于(50-a)mL
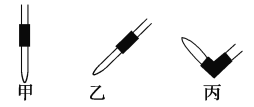
(3)排去碱式滴定管中气泡的方法应采用如图所示操作中的____________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(4)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO=3H++6H2O+(CH2)6N4H+
滴定时,1mol (CH2)6N4H+与1mol H+相当,然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g。
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
A 滴定管内液面的变化 B 锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变成 色。
(2)滴定结果如下表所示:
滴定次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010mo1·L-1,则该样品中氮的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应可用于合成CH3OH:
![]()
(1)Mn2+基态核外电子排布式为____________。
(2)与NO3-互为等电子体的分子为_______(写化学式)。
(3)CO32-的空间构型是________(用文字描述)。
(4)1molCH3OH中含有σ键的数目为______mol。CH3OH与H2O可以任意比互溶,除因为它们都是极性分子外,还因为________。
(5)锰元素的一种硫化物晶体的晶胞结构如图所示,该硫化物的化学式为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯。
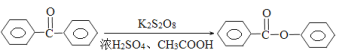
制备苯甲酸苯酯的实验步骤为:
步骤1:将20mL浓H2SO4与40mL冰醋酸在下图装置的烧杯中控制在5℃以下混合。

步骤2:向烧杯中继续加入过硫酸钾25g,用电磁搅拌器搅拌4~5分钟,将二苯甲酮9.1g溶于三氯甲烷后,加到上述混合液中,控制温度不超过15℃,此时液体呈黄色。
步骤3:向黄色液体中加水,直至液体黄色消失,但加水量一般不超过1mL,室温搅拌5h。
步骤4:将反应后的混合液倒入冰水中,析出苯甲酸苯酯,抽滤产品,用无水乙醇洗涤,干燥
(1)步骤1中控制在5℃以下混合的原因为 。
(2)步骤2中为控制温度不超过15℃,向混合液中加入二苯甲酮的三氯甲烷溶液的方法是 。
(3)步骤3中加水不超过1mL,原因是 。
(4)步骤4中抽滤用到的漏斗名称为 。
(5)整个制备过程中液体混合物会出现褐色固体,原因是 ;除去该固体操作为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2·H2O也是一元弱碱,25℃时电离常Kb=4.0×10-5。现用0.0500mol/L的稀硫酸滴定10mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示。下列说法正确的是
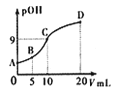
A. 甲胺在水中的电离方程式为:CH3NH2·H2O=CH3NH3++OH-
B. A、B、C三点溶液中,水电离出来的c(H+):B>C>A
C. C点所在溶液中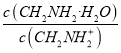 =2.5×10-5
=2.5×10-5
D. B点溶液中存在c(CH3NH2·H2O)>c(CH3NH3+)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com