
【题目】A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.它们之间的关系如下:
Ⅰ.原子半径:A<C<B<E<D
Ⅱ.原子的最外层电子数:A=D、C=E、A+B=C
Ⅲ.原子的核外电子层数:B=C=2A、D=E
Ⅳ.B元素的主要化合价:最高正价+最低负价=2
V.F的单质或合金是用量最大的金属材料
请回答:
(1)甲是由A、B两种元素按原子个数比为3:1组成的物质,乙是由C、D两种元素按原子个数比为1:2组成的物质,用电子式分别表示甲和乙的形成过程:
甲:;
乙: .
(2)写出含F的黑色磁性氧化物与B元素的最高价氧化物对应的水化物的稀溶液反应的离子方程式: .
(3)上述元素A、B、C、D、E、F中五种元素可形成一种常见复盐,经检测该复盐由三种离子组成,且离子个数比为1:1:2,向该盐溶液中加入酸化的BaCl2溶液产生白色沉淀;加入NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,则该复盐的化学式为:;
(4)将上述复盐配成0.1L 0.1mol/L的溶液,向其中加入0.06mol BaCl2固体完全反应后,该溶液中c(SO42﹣)为(已知:忽略溶液体积变化.该沉淀的KSP=2×10﹣9)
【答案】
(1)![]() ;
;![]()
(2)3Fe3O4+28H++NO3﹣=9Fe3++NO↑+14H2O
(3)NH4Fe(SO4)2
(4)5×10﹣9mol/L
【解析】解:A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.原子的核外电子层数:B=C=2A,则A处于第一周期,B、C处于第二周期,则A为H元素;B元素的主要化合价:最高正价+最低负价=2,B处于ⅤA族,则B为N元素;原子的最外层电子数:A=D,C=E,则A、D同主族,C、E同主族,可推知D为Na,最外层电子数A+B=C,则C的最外层电子数=1+5=6,可推知C为O元素、E为S元素;F的单质或合金是用量最大的金属材料,(1)由H、N两种元素按原子数之比为3:1组成的物质甲为NH3 , 用电子式表示形成过程为 ![]() ,
,
由O、Na两种元素按原子个数比为1:2组成的物质乙为Na2O,用电子式表示形成过程为 ![]() ,
,
所以答案是: ![]() ;
; ![]() ;(2)含Fe元素的黑色磁性氧化物为Fe3O4 , 与稀硝酸反应生成硝酸铁、NO与水,反应离子方程式为:3Fe3O4+28H++NO3﹣=9Fe3++NO↑+14H2O,
;(2)含Fe元素的黑色磁性氧化物为Fe3O4 , 与稀硝酸反应生成硝酸铁、NO与水,反应离子方程式为:3Fe3O4+28H++NO3﹣=9Fe3++NO↑+14H2O,
所以答案是:3Fe3O4+28H++NO3﹣=9Fe3++NO↑+14H2O;(3)上述元素中H、N、O、S、Fe的五种元素可形成一种常见复盐,向该盐溶液加入酸化的BaCl2溶液,产生白色沉淀,该盐含有SO42﹣ , 加入NaOH溶液并加热,产生能使湿润红色石蕊试纸变蓝的气体,该盐含有NH4+ , 经检测该复盐由三种离子组成且离子个数比为1:1:2,由电荷守恒可知,含有Fe3+ , 则该复盐的化学式为NH4Fe(SO4)2 ,
所以答案是:NH4Fe(SO4)2;(4)将上述复盐配成0.1L 0.1mol/L的溶液,向其中加入0.06mol的BaCl2固体完全反应后,溶液中c(Ba2+)≈ ![]() ﹣0.1mol/L×2=0.4mol/L,该溶液中c(SO42﹣)×c(Ba2+)=2×10﹣9 , 故c(SO42﹣)=5×10﹣9mol/L,
﹣0.1mol/L×2=0.4mol/L,该溶液中c(SO42﹣)×c(Ba2+)=2×10﹣9 , 故c(SO42﹣)=5×10﹣9mol/L,
所以答案是:5×10﹣9mol/L.


科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如右图所示,下列说法中不正确的是
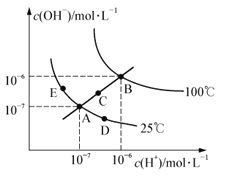
A.图中五点的KW间的关系为:B>C>A=D=E
B.若从A点到D点,可采用:恒温条件下,在水中加入少量的醋酸,提高溶液酸性
C.若从A点到C点,可采用:恒温条件下,在水中加入少量的醋酸铵,促进水的电离
D.100℃时,将pH=2的硫酸与0.01mol·L-1的KOH溶液等体积混合后,溶液中c(H+)=c(OH-)=10-6mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是( )
A. 室温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为:c(Cl-)>c(NH![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
B. 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C. 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D. 室温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol镁和铝的混合物溶于100 mL 2 mol/L 稀硫酸中,然后滴加1 mol/L的NaOH溶液。若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液体积的变化如图所示,下列说法正确的是

A. 当V1=150 mL时,金属粉末中镁粉的质量分数为50%
B. 若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=400mL。
C. 若其中镁粉的物质的量分数为a,用100 mL 2 mol/L稀硫酸溶解此混合物后,再加入450 mL 1 mol/L NaOH溶液,所得沉淀中无Al(OH)3,则a的取值范围为![]() <a<1
<a<1
D. 若在滴加NaOH溶液的体积为V2时,溶液中溶质为NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水.请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)___________。
(2)④、⑤、⑥、⑦四种溶液中NH![]() 浓度由大到小的顺序是(填序号)_______________。
浓度由大到小的顺序是(填序号)_______________。
(3)将③和④按体积比1∶2混合后,混合液中各离子浓度由大到小的顺序是:__________________。
(4)已知t ℃时,KW=1×10-13,则t ℃(填“>”、“<”或“=”)________25℃。在t ℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足表中图示物质在一定条件下一步转化关系的组合有
序号 | X | Y | Z | W |
|
① | Si | Na2SiO3 | H2SiO3 | SiO2 | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. ①②③ B. ①③④ C. ②③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有(1)乙酸乙酯和乙酸钠溶液、(2)溴化钠和溴水的混合液,分离它们的正确方法依次是( )
A. 分液、萃取 B. 萃取、分液 C. 分液、蒸馏 D. 蒸馏、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的容器中发生反应:H2(g)+CO(g) ![]() C(s)+H2O(g).初始时加入平均相对分子质量为 15 的 H2、CO 混合气体,反应一段时间后测得气体的平均相对分子质量为 16,下列说法正确的( )
C(s)+H2O(g).初始时加入平均相对分子质量为 15 的 H2、CO 混合气体,反应一段时间后测得气体的平均相对分子质量为 16,下列说法正确的( )
A. 反应前后气体的压强之比为 2:1
B. 此时 CO 的转化率为 50%
C. 反应前后气体的密度之比为 15:14
D. 如果反应继续向正向进行,气体的平均相对分子质量将减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com