
【题目】将0.1 mol镁和铝的混合物溶于100 mL 2 mol/L 稀硫酸中,然后滴加1 mol/L的NaOH溶液。若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液体积的变化如图所示,下列说法正确的是

A. 当V1=150 mL时,金属粉末中镁粉的质量分数为50%
B. 若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=400mL。
C. 若其中镁粉的物质的量分数为a,用100 mL 2 mol/L稀硫酸溶解此混合物后,再加入450 mL 1 mol/L NaOH溶液,所得沉淀中无Al(OH)3,则a的取值范围为![]() <a<1
<a<1
D. 若在滴加NaOH溶液的体积为V2时,溶液中溶质为NaAlO2
【答案】D
【解析】A、当V1=150mL时,此时溶液是MgSO4、Al2(SO4)3 和Na2SO4混合液,由Na+离子守恒可知,n(Na2SO4)=1/2 n(Na+)=1/2 n(NaOH)=1/2×0.15L×1mol·L-1=0.075mol,设MgSO4为xmol,Al2(SO4)3为ymol,根据Mg原子、Al原子守恒可得:x+2y=0.1,根据SO42-离子守恒可知:x+3y=0.2-0.075,联立方程解得:x=0.05、y=0.025,镁粉的物质的量分数为50%,而不是质量分数,故A错误;B、当溶液中Mg2+、Al3+恰好沉淀完全时,此时的溶液为Na2SO4溶液,根据SO42-离子和Na+离子守恒可得:n(Na+)=2n(Na2SO4)=2(H2SO4)=2×0.1L×2mol·L-1=0.4mol,所以滴入NaOH溶液的体积为V(NaOH)=0.4mol/1mol·L-1=0.4L=400mL,故B正确;C、混合物为0.1mol,其中镁的物质的量分数为a,用100mL2mol/L硫酸溶解后,再加入450mL 1mol/L氢氧化钠溶液,所得溶液无Al(OH)3 沉淀,证明生成的氢氧化铝全部和氢氧化钠反应,结合B选项:v1=400mL,再加入50mL 1mol/L氢氧化钠溶液,所得Al(OH)3 沉淀完全溶于氢氧化钠生成偏铝酸钠,Al(OH)3 +NaOH=NaAlO2+2H2O,Al(OH)3 最大取值0.05mol,即0<n(Al)≤0.05mol,n(Mg)+n(Al)=0.1mol,则0.5≤n(Mg)<1,即0.5≤a<1;D、 若在滴加NaOH溶液的体积为V2时,溶液中溶质为NaAlO2和Na2SO4混合液,故D错误;故选B。


科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是( )
A. 用长颈漏斗分离出乙酸与乙醇反应的产物
B. 用向上排空气法收集铜粉与稀硝酸反应产生的![]()
C. 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
D. 将![]() 与
与![]() 混合气体通过饱和食盐水可得到纯净的
混合气体通过饱和食盐水可得到纯净的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石主要成分是Cu2(OH)2CO3,还含少量FeCO3及Si的化合物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
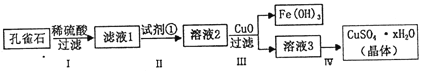
(1)步骤I中涉及的主要反应用离子方程式表示为___________.
(2)步骤Ⅱ中试剂①是_______(填代号).
a.KMnO4 b.H2O2 c.Fe粉 d.KSCN
(3)步骤Ⅲ加入CuO 的目的是_________
(4)步骤Ⅳ获得硫酸铜晶体,需要经过_____________冷却结晶、过滤等操作.
(5)测定硫酸铜晶体(CuSO4·xH2O)中结晶水的x值:称取2.41g硫酸铜晶体,在____(填实验仪器名称)中加热至质量不再改变时,称量粉末的质量为1.6g.则计算得x=______(计算结果精确到0.1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关说法正确的是( )
A.维生素C具有还原性,在人体内起抗氧化作用
B.糖类、蛋白质、油脂属于天然高分子化合物
C.煤经气化和液化两个物理变化过程,可变为清洁能源
D.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,CH3COONH4显中性.
Ⅰ.将0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合(混合后溶液的体积变化忽略不计)测得混合溶液的pH=9.回答下列问题:
(1)用离子方程式表示混合溶液的pH=9的原因: .
(2)混合溶液中c(CH3COOH)=mol/L(列式,不必化简).
(3)相同温度相同浓度的下列四种溶液:①(NH4)2CO3②CH3COONH4③(NH4)2SO4④NH4Cl,pH由大到小的顺序为:(填序号).
Ⅱ.Mg(OH)2沉淀可溶于NH4Cl溶液.同学们对有关该反应的原理的解释如下:甲同学认为是NH4Cl水解,溶液呈酸性,H+中和了Mg(OH)2电离出的OH﹣导致沉淀溶解;乙同学认为是NH4+与Mg(OH)2电离出的OH﹣反应生成弱电解质NH3H2O导致沉淀溶解.
(4)丙同学不能肯定哪位同学的解释合理,于是选用下列一种试剂来验证甲、乙两同学的观点,他选用的试剂是:
A.NH4NO3
B.CH3COONH4
C.Na2CO3
D.NH3H2O
(5)丙同学将所选试剂滴加到Mg(OH)2的悬浊液中,Mg(OH)2溶解,由此可知:(填“甲”或“乙”)的解释更为合理.Mg(OH)2沉淀与NH4Cl反应的离子方程式为: .
(6)现有Mg(OH)2和Al(OH)3沉淀的混合物,若要除去Al(OH)3得到纯净的Mg(OH)2 , 可用;若要除去Mg(OH)2得到纯净的Al(OH)3 , 可用;(写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.它们之间的关系如下:
Ⅰ.原子半径:A<C<B<E<D
Ⅱ.原子的最外层电子数:A=D、C=E、A+B=C
Ⅲ.原子的核外电子层数:B=C=2A、D=E
Ⅳ.B元素的主要化合价:最高正价+最低负价=2
V.F的单质或合金是用量最大的金属材料
请回答:
(1)甲是由A、B两种元素按原子个数比为3:1组成的物质,乙是由C、D两种元素按原子个数比为1:2组成的物质,用电子式分别表示甲和乙的形成过程:
甲:;
乙: .
(2)写出含F的黑色磁性氧化物与B元素的最高价氧化物对应的水化物的稀溶液反应的离子方程式: .
(3)上述元素A、B、C、D、E、F中五种元素可形成一种常见复盐,经检测该复盐由三种离子组成,且离子个数比为1:1:2,向该盐溶液中加入酸化的BaCl2溶液产生白色沉淀;加入NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,则该复盐的化学式为:;
(4)将上述复盐配成0.1L 0.1mol/L的溶液,向其中加入0.06mol BaCl2固体完全反应后,该溶液中c(SO42﹣)为(已知:忽略溶液体积变化.该沉淀的KSP=2×10﹣9)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)= 9×10-4,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断中正确的是

A. a点对应的溶液中c(H+)·c(OH-) 的数值为1×10-14
B. a 点对应的Ksp不等于c点对应的Ksp
C. b 点将有沉淀生成,平衡后溶液中c(SO42-)= 3×10-3mol/L,而向d 点溶液中加入适量的CaSO4固体可以变到c 点
D. CaSO4的饱和溶液中c(SO42-) > c(Ca2+) >c(H+) >c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1mol氢气完全燃烧生成水蒸气时放出热量242kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H﹣O键形成时放出热量463kJ,则氢气中1mol H﹣H键断裂时吸收热量为( )
A.920 kJ
B.557 kJ
C.436 kJ
D.188 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com