
����Ŀ����һ���¶��£��̶��ݻ��������м���a mol A��b mol B��������Ӧ��
A(g)+2B(g)![]() 2C(g)һ��ʱ���ﵽƽ�⣬����n mol C��������˵���в���ȷ����
2C(g)һ��ʱ���ﵽƽ�⣬����n mol C��������˵���в���ȷ����
A���ٳ�������A��ƽ��������Ӧ�����ƶ�����Kֵ����
B����ʼʱ�̺ʹﵽƽ��������е�ѹǿ֮��Ϊ(a+b)��(a+b��![]() )[
)[
C����2v��(A)=v��(B)ʱ����Ӧһ���ﵽƽ��״̬
D�������������(��Ar)����ѹǿ��ƽ��������Ӧ�����ƶ�
���𰸡�D
��������
���������A���ٳ�������A��������Ӧ��Ũ�ȣ���ѧƽ�������ƶ��������¶Ȳ��䣬��ѧƽ�ⳣ�����䣬��A��ȷ��B�����ݷ�ӦA(g)+2B(g)![]() 2C(g)��ʼ���ʵ���֮����a+b���ﵽƽ������ʵ���֮����(a+b-
2C(g)��ʼ���ʵ���֮����a+b���ﵽƽ������ʵ���֮����(a+b-![]() )����ѧ��Ӧ�����ʵ���֮�ȵ���ѹǿ֮�ȣ���Ϊ(a+b)��(a+b-
)����ѧ��Ӧ�����ʵ���֮�ȵ���ѹǿ֮�ȣ���Ϊ(a+b)��(a+b-![]() )��B��ȷ��C����2v��(A)=v��(B)ʱ��֤�����淴Ӧ������ȣ���ѧ��Ӧ�ﵽƽ��״̬����C��ȷ��D�������������(��Ar)����ϵ������䣬���Է�Ӧ�и����Ũ�Ȳ��䣬��ѧƽ�ⲻ�ƶ�����D����ѡD��
)��B��ȷ��C����2v��(A)=v��(B)ʱ��֤�����淴Ӧ������ȣ���ѧ��Ӧ�ﵽƽ��״̬����C��ȷ��D�������������(��Ar)����ϵ������䣬���Է�Ӧ�и����Ũ�Ȳ��䣬��ѧƽ�ⲻ�ƶ�����D����ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ϊ1.0 L���������ܱ������м�����������ͬ��̼�ۣ��ٷֱ����0.1 mol CO2��0.2 mol CO2���ڲ�ͬ�¶��·�ӦCO2(g)��C(s)![]() 2CO(g)�ﵽƽ�⣬ƽ��ʱc(CO2) ���¶ȵı仯��ͼ��ʾ��ͼ�Т������������ϣ�������˵����ȷ����
2CO(g)�ﵽƽ�⣬ƽ��ʱc(CO2) ���¶ȵı仯��ͼ��ʾ��ͼ�Т������������ϣ�������˵����ȷ����
A���÷�Ӧ�Ħ�H��0����S��0
B����ϵ����ѹǿp��p(��)��p(��)
C��ƽ�ⳣ����K(��)��K(��)
D��T1Kʱ������������״̬��v(��)��v(��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ����ƻ�ѧʽ����ɫ��һ�µ���
A. �������ƣ�����ɫ�� B. NO2������ɫ��
C. NO����ɫ�� D. ���⣨��ɫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� �й�����������������У���ȷ����
A. ���������е���AgNO3��Һ�������е���ɫ��������
B. �����鲻����ˮ�������ڴ�����л��ܼ�
C. ��������NaOH�Ĵ���Һ��Ӧ���������Ҵ�
D. ������ͨ������������ֱ�ӷ�Ӧ����ȡ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��A~J��Ϊ��ѧ��ѧ�г��������ʣ�����֮��������ת����ϵ������A��DΪ�������ʣ�AԪ�ص�������Ϊ�������ڰ뾶��С�����ӡ���Ӧ���������ɵ�ˮ��������������ȥ����ش��������⣺

��1��B________�� F_______��H_______�����ѧʽ��
��2��д��A��B��Ӧ�Ļ�ѧ����ʽ��_______________________________��
��3��д��H�ڿ�����ת����I�ķ�Ӧ�Ļ�ѧ����ʽ��_________________��
��4��5.4 g A�ĵ�����100 mL 3 mol/L HCl��Һ��Ӧ�������ɱ���µ�����_________L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ���У�������ʵ������ʼʱ����С�Թ��еĵ����ڵ�Һ���½���һ��ʱ����ڵ�Һ��������Ը���U���е�Һ�档�����йؽ��Ͳ���������

A. ����Ƭ��������̼����ǿ���Ŀ���ʴ��
B. ��ˮ���Խ�ǿ������Ƭ��ʼ�������ⸯʴ
C. ������īˮҺ�����ʱ��������Ӧʽ��O2��2H2O��4e��==4OH��
D. ���ŷ�Ӧ�Ľ��У�U������ˮ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������2molSO2��1molO2�����������ɱ䣬ѹǿ�㶨���ܱ������У���һ���¶��·������·�Ӧ��2SO2(g)+O2(g) ![]() 2SO3(g)����H��0������Ӧ�ﵽƽ��״̬����û�����������ʵ���Ϊ2.1 mol����ƽ��ʱSO2���������Ϊ ��
2SO3(g)����H��0������Ӧ�ﵽƽ��״̬����û�����������ʵ���Ϊ2.1 mol����ƽ��ʱSO2���������Ϊ ��
��ij��ȤС���ͬѧ����ͼ��ʾװ���о��йص绯ѧ������(�ס��ҡ�����������������)�����պϸ�װ�õĵ��Kʱ���۲쵽�����Ƶ�ָ�뷢����ƫת�����ҳ���C����������10.8 gʱ���ش��������⡣

��1���׳���B�缫����������O2�����(��״����) mL��
��2������������Һ�����Ϊ1000 mL����ʱ��������Һ��pHΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��Ϊ��ѧ��ѧ�ij��������Ҿ�����ͬһ��Ԫ�أ�����֮���ת����ϵ����ͼ��ʾ(��Ӧ���������������Ѿ���ȥ)��
![]()
��1����A��һ�ֽ�����C�ǵ���ɫ���壬д��C��һ����; ��
��2����AΪ����ɫ���嵥�ʣ�ʵ���ҳ����ڼ���B���Լ��� ��
��3����AΪ���ʣ�DΪ���ᣬ��A�ڹ�ҵ�����п������Ʊ��ֹ裬�÷�Ӧ�Ļ�ѧ����ʽΪ ��
��4����A�ǻ����C�Ǻ���ɫ���壬��A��D��Ӧ�IJ��ﻯѧʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)Na2S2O3����Ҫ�Ļ���ԭ�ϣ�������ˮ�������Ի���Ի������ȶ���
Ϊ�ⶨ��Ʒ���ȣ�����������ʵ�飺ȷ��ȡW g��Ʒ������������ˮ�ܽ⣬�Ե�����ָʾ������0.100 0 mol��L��1��ı���Һ�ζ���
��Ӧԭ��Ϊ��
2S2O![]() ��I2=S4O
��I2=S4O![]() ��2I��
��2I��
���ζ����յ�ʱ����Һ��ɫ�ı仯��_____________________________��
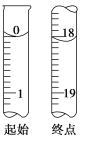
���ⶨ��ʼ���յ��Һ��λ����ͼ�������ĵ�ı���Һ���Ϊ________mL����Ʒ�Ĵ���Ϊ(��Na2S2O3��5H2O��Է�������ΪM)__________________ ______________��
(2)����I2�������Կɲⶨ��������ĺ����������ǽ������е���ת����H2SO3��Ȼ����һ��Ũ�ȵ�I2��Һ���еζ�������ָʾ��Ϊ______________���ζ���Ӧ�����ӷ���ʽΪ__________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com