
【题目】工业上通常采用N2(g)和H2(g)催化成NH3(g):N2(g)+3H2(g)![]() 2NH3(g) ΔH=﹣92.4 kJmol﹣1。
2NH3(g) ΔH=﹣92.4 kJmol﹣1。
(1)在一定温度下,若将10amol N2和30amol H2放入2 L的密闭容器中,充分反应后测得平衡时N2的转化率为60%,则该反应的平衡常数为________(用含a的代数式表示)。若此时再向该容器中投入10amol N2、20amol H2和20amol NH3,判断平衡移动的方向是______(填“正向移动”“逆向移动”或“不移动”)。
(2)若反应起始时N2、H2、NH3的浓度分别为0.1 mol·L﹣1、0.3 mol·L﹣1、0.1 mol·L﹣1,则NH3达到平衡时浓度的范围为_____;若平衡时N2、H2、NH3的浓度分别为0.1 mol·L﹣1、0.3 mol·L﹣1、0.1 mol·L﹣1,则NH3起始时浓度的范围为_____。
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
容,测得反应达到平衡时的有关数据如表:
容器 反应物投入量 | 甲 | 乙 | 丙 | |
1molN2、3molH2 | 2molNH3 | 4molNH3 | ||
平衡时数据 | 反应能量变化的绝对值(kJ) | Q1 | Q1 | Q1 |
反应物转化率 | a1 | a2 | a3 | |
体系压强(Pa) | p1 | p2 | p3 | |
则Q1+Q2=___kJ;a1+a2___l(填“<”“>”或“=”,下同),2p2___p3。
【答案】![]() 正向移动 0 mol·L﹣1<c(NH3)<0.3 mol·L﹣1 0 mol·L﹣1≤c(NH3)≤0.3 mol·L﹣1 92.4 = >
正向移动 0 mol·L﹣1<c(NH3)<0.3 mol·L﹣1 0 mol·L﹣1≤c(NH3)≤0.3 mol·L﹣1 92.4 = >
【解析】
(1)利用三段法计算出平衡时各物质的浓度,再计算平衡常数,然后利用Q与K的关系来分析平衡的移动;
(2)可假设反应正向进行或逆向进行达到平衡,并结合可逆反应的限度来判断即可;
(3)甲容器反应物投入1 mol N2、3 mol H2,乙容器反应物投入量2 mol NH3,恒温且乙容器容积和甲容器相同,则甲容器与乙容器是等效平衡;
甲容器反应物投入1 mol N2、3 mol H2,丙容器反应物投入量4 mol NH3,采用极限转化法转化为反应物为2 mol N2、6 mol H2,是甲中的二倍,如果恒温且丙容器容积是甲容器2倍,则甲容器与丙容器也是等效平衡;所以丙所到达的平衡,可以看作在恒温且容积是甲容器两倍条件下,到达平衡后,再压缩体积为与甲容器体积相等所到达的平衡;据此分析平衡移动。
(1)由将10amol N2和30amol H2放入2L的密闭容器中,充分反应后测得N2的转化率为60%,则转化的N2的物质的量为10a mol![]() 60%=6a mol,
60%=6a mol,
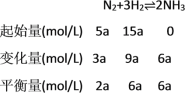 ,则平衡常数K=
,则平衡常数K=![]() =
=![]() ,故答案为:
,故答案为:![]() ;
;
若此时再向该容器中投入10amol N2、20amol H2和20amol NH3,三者的浓度分别为:7a mol/L、16a mol/L、16a mol/L;则浓度商Qc=![]() =
=![]() <K,此时平衡正向进行;
<K,此时平衡正向进行;
故答案为:![]() ;正向移动;
;正向移动;
(2) 若反应起始时N2、H2、NH3的浓度分别为0.1 mol·L﹣1、0.3 mol·L﹣1、0.1 mol·L﹣1,假设反应正向进行,则N2的最大转化浓度为0.1 mol·L﹣1,则NH3的变化浓度为0.2 mol·L﹣1,即平衡时NH3的浓度小于0.3 mol·L﹣1,假设反应逆向进行,则NH3的变化浓度最大为0.1mol/L,即平衡时NH3的最小浓度为大于0 mol·L﹣1,故NH3达到平衡时浓度的范围为0 mol·L﹣1<c(NH3)<0.3 mol·L﹣1;若平衡时N2、H2、NH3的浓度分别为0.1 mol·L﹣1、0.3 mol·L﹣1、0.1 mol·L﹣1,如果反应是从反应物方向开始的,NH3的起始浓度为0 mol·L﹣1,如果反应是生成物方向进行的,生成0.1 mol·L﹣1N2时消耗NH3的浓度分别为0.05 mol·L﹣1,NH3的起始浓度为0.15mol/L,NH3起始时浓度的范围为0 mol·L﹣1c(NH3)0.3 mol·L﹣1;
故答案为:0 mol·L﹣1<c(NH3)<0.3 mol·L﹣1;0 mol·L﹣1≤c(NH3)≤0.3 mol·L﹣1;
(3)甲投入1 mol N2、3 mol H2,乙中投入2 mol NH3,则甲与乙是完全等效的,根据盖斯定律可知,甲与乙的反应的能量变化之和为92.4 kJ,Q1+Q2=92.4;转化率α1+α2=1;丙容器反应物投入量4 mol NH3,是乙的二倍,若平衡不移动,丙中压强为乙的二倍,由于丙中相当于增大压强,平衡向着向着正向移动,所以丙中压强减小,小于乙的2倍,即2p2>p3;
故答案为:92.4;=


科目:高中化学 来源: 题型:
【题目】已知6.2克某有机物在氧气中完全燃烧,其产物(100 ℃)依次通过盛有浓硫酸的洗气瓶、盛有碱石灰的干燥管全部被吸收后,洗气瓶的质量增加5.4克,干燥管的质量增加8.8克。
(1)计算确定该有机物的最简式。_________________
(2)相同条件下,若该有机物蒸气相对氢气的密度为31,计算确定该有机物的分子式。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“点击化学”是指快速、高效连接分子的一类反应,例如铜催化的Huisgen环加成反应:

我国科研人员利用该反应设计、合成了具有特殊结构的聚合物F并研究其水解反应。合成线路如下图所示:
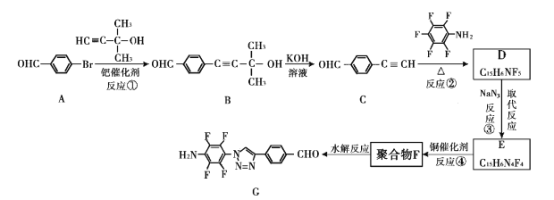
已知:![]()
(1)A生成B的反应类型是____。
(2)关于B和C,下列说法正确的是____(填字母序号)。
a 利用核磁共振氢谱可以鉴别B和C b B不能发生消去反应 c 可用酸性高锰酸钾溶液检验C中含醛基
(3)B生成C的过程中还有另一种生成物X,分子式为C3H6O,核磁共振氢谱显示只有一组峰,X的结构简式为 ___。
(4)反应②的化学方程式为 ___。
(5)请根据以上流程,并推测聚合物F所具有的特殊结构,下列关于聚合物F的结构说法正确的是___
A F中必含 -CH2=N- 结构
B F中必含 -N=N- 结构
C F的结构可能是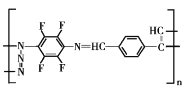
(6)H是比A多一个碳原子的同系物。H的同分异构体中符合下列条件的有 ___种。
①苯环上有三个取代基 ②能和FeCl3发生显色反应
(7)为了探究连接基团对聚合反应的影响,设计了单体K,其合成路线如下,写出H、I、J的结构简式:___
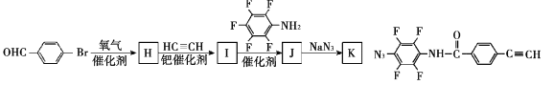
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 L的密闭容器中,发生反应4A(s)+3B(g)![]() 2C(g)+D(g),经2 min后B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )
2C(g)+D(g),经2 min后B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )
A. 用A表示的反应速率是0.4 mol·L-1·min-1
B. 用BCD分别表示反应的速率,其比值是3∶2∶1
C. 在第2 min末的反应速率用B表示是0.3 mol·L-1·min-1
D. 在这2 min内用B表示的速率的值逐渐减小,用C表示的速率的值逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为减少二氧化碳排放,我国科学家设计熔盐电解池捕获二氧化碳的装置,如图所示。下列说法不正确的是
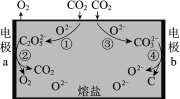
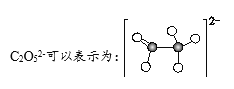
A.过程①中有碳氧键断裂
B.过程②中C2O52-在a极上发生了还原反应
C.过程③中的反应可表示为:CO2+O2- == CO32-
D.过程总反应:CO2![]() C+O2
C+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定0.1mol·L-1Na2SO3溶液先升温再降温过程中的pH,数据如下表。实验过程中,取①、④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。下列说法不正确的是( )
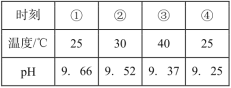
A.Na2SO3溶液中存在水解平衡:SO32-+H2O![]() HSO3-+OH-
HSO3-+OH-
B.④产生的白色沉淀是BaSO4
C.①→③的过程中,c(SO32-)在降低
D.①→③的过程中,温度与c(SO32-)相比,前者对水解平衡的影响更大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4在医疗上有广泛地应用,可用于防腐、制药、消毒等。现以软锰矿(主要成分为MnO2,含有少量Al2O3、SiO2等)为原料制备KMnO4的工业流程如图所示。

(1)料渣的主要成分是____,操作2的意义是__________。
(2)“调pH”的目的是__________;写出“氧化”过程中发生反应的离子方程式:________;熔融过程中,氧化剂与还原剂的物质的量之比为_______。
(3)操作3的内容为蒸发浓缩、趁热过滤、洗涤、烘干,已知KHCO3、KMnO4的溶解度曲线是下图中的两种,则KHCO3、KMnO4的溶解度曲线分别是_____(填序号)。

(4)用惰性电极电解K2MnO4溶液也可得到目标产物,则生成目标产物的电极反应式为___________,充分电解后,得到的溶液中溶质的主要成分是______和KMnO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室用自来水制取蒸馏水的实验中,下列说法正确的是( )
A.蒸馏烧瓶中加满自来水并放入几粒沸石
B.冷凝水应该是下进上出,与蒸气的流向相反
C.开始蒸馏时,应该先加热,再通冷凝水
D.蒸馏完毕时,应该先停止通冷凝水再撤酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(ρ=1.84 g·mL-1)配制1∶5的稀硫酸(ρ=1.19 g·mL-1)。
(1)浓硫酸的物质的量浓度是________。
(2)稀硫酸的物质的量浓度是________。
(3)稀硫酸的质量分数是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com