
【题目】为减少二氧化碳排放,我国科学家设计熔盐电解池捕获二氧化碳的装置,如图所示。下列说法不正确的是
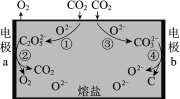
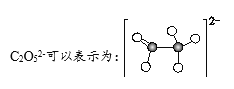
A.过程①中有碳氧键断裂
B.过程②中C2O52-在a极上发生了还原反应
C.过程③中的反应可表示为:CO2+O2- == CO32-
D.过程总反应:CO2![]() C+O2
C+O2
【答案】B
【解析】
a极上,电极反应有:4CO2+2O2-=2C2O52-,2C2O52--4e-=4CO2↑+O2↑,总的电极反应为:2O2--4e-=O2↑;b极上,电极反应有:CO2+O2-=CO32-,CO32-+4e-=C+3O2-,总的电极反应为:CO2+4e-=C+2O2-;熔盐电池的总的化学方程式为:CO2![]() C+O2。
C+O2。
A、过程①的离子反应为:2CO2+O2-=C2O52-,其中CO2的结构式为O=C=O,对比CO2和C2O52-的结构式可知,该过程有碳氧键断裂,A正确;
B、过程②中,a极的电极反应为:2C2O52--4e-=4CO2↑+O2↑,该电极反应为氧化反应,B错误;
C、根据题中信息,可以推出过程③中的反应可表示为:CO2+O2-=CO32-,C正确;
D、经分析,熔盐电池的总的化学方程式为CO2![]() C+O2,D正确;
C+O2,D正确;
故选B。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】食品香精菠萝酯的生产路线(反应条件略去)如下:
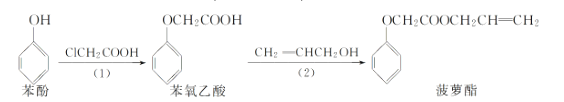
下列叙述错误的是( )
A.步骤(1)产物中残留的苯酚可用![]() 溶液检验
溶液检验
B.苯酚和菠萝酯均可与酸性![]() 溶液发生反应
溶液发生反应
C.苯氧乙酸和菠萝酯均可与![]() 溶液发生反应
溶液发生反应
D.步骤(2)产物中残留的烯丙醇可用溴水检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业炼铜的原料,含有的主要元素是硫、铁、铜,请回答下列问题。
(l)基态硫原子中核外电子有____种空间运动状态。Fe2+的电子排布式是 ___。
(2)液态SO2可发生白偶电离2SO2=SO2++SO32-,SO32-的空间构型是 ___,与SO2+互为等电子体的分子有____(填化学式,任写一种)。
(3)CuCl熔点为426℃,融化时几乎不导电,CuF的熔点为908℃,沸点1100℃,都是铜(I)的卤化物,熔沸点相差这么大的原因是 ___。
(4)乙硫醇(C2H5SH)是一种重要的合成中间体,分子中硫原子的杂化形式是____。乙硫醇的沸点比乙醇的沸点____(填“高”或“低”),原因是____。
(5)黄铜矿主要成分X的晶胞结构及晶胞参数如图所示,X的化学式是 ___,其密度为 ___g/cm3(阿伏加德罗常数的值用NA表示)。
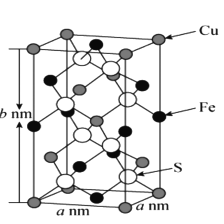
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池常用于航天飞船,由电极反应产生的水经冷凝后可作为航天员的饮用水,其电极反应如下:
负极:2H2+4OH--4e-=4H2O
正极:O2+2H2O+4e-=4OH-
当得到1.8 kg饮用水时,电池内转移电子的物质的量为
A.1.8 mol
B.3.6 mol
C.100 mol
D.200 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应X2+3Y2![]() 2Z2在反应过程中,反应速率(v)与时间(t)关系曲线如图所示,下列叙述不正确的
2Z2在反应过程中,反应速率(v)与时间(t)关系曲线如图所示,下列叙述不正确的

A.t1时,正反应速率大于逆反应速率
B.t1~t2,逆反应速率逐渐减小
C.t2时,正反应速率与逆反应速率相等
D.t2~t3,各物质的浓度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常采用N2(g)和H2(g)催化成NH3(g):N2(g)+3H2(g)![]() 2NH3(g) ΔH=﹣92.4 kJmol﹣1。
2NH3(g) ΔH=﹣92.4 kJmol﹣1。
(1)在一定温度下,若将10amol N2和30amol H2放入2 L的密闭容器中,充分反应后测得平衡时N2的转化率为60%,则该反应的平衡常数为________(用含a的代数式表示)。若此时再向该容器中投入10amol N2、20amol H2和20amol NH3,判断平衡移动的方向是______(填“正向移动”“逆向移动”或“不移动”)。
(2)若反应起始时N2、H2、NH3的浓度分别为0.1 mol·L﹣1、0.3 mol·L﹣1、0.1 mol·L﹣1,则NH3达到平衡时浓度的范围为_____;若平衡时N2、H2、NH3的浓度分别为0.1 mol·L﹣1、0.3 mol·L﹣1、0.1 mol·L﹣1,则NH3起始时浓度的范围为_____。
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
容,测得反应达到平衡时的有关数据如表:
容器 反应物投入量 | 甲 | 乙 | 丙 | |
1molN2、3molH2 | 2molNH3 | 4molNH3 | ||
平衡时数据 | 反应能量变化的绝对值(kJ) | Q1 | Q1 | Q1 |
反应物转化率 | a1 | a2 | a3 | |
体系压强(Pa) | p1 | p2 | p3 | |
则Q1+Q2=___kJ;a1+a2___l(填“<”“>”或“=”,下同),2p2___p3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。
①CN-中N元素显-3价,用原子结构解释N元素显负价的原因是_______。
②NaClO溶液可将CN-氧化成N2、HCO3-,从而消除CN-污染,反应的离子方程式为_____。
(2)含乙酸钠和对氯酚(![]() )的废水可以利用微生物电池除去,其原理如图所示。
)的废水可以利用微生物电池除去,其原理如图所示。
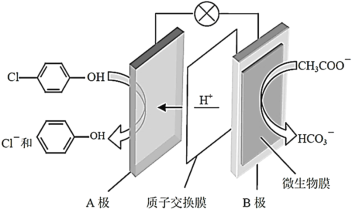
①A是电池的_________极(填“正”或“负”);
②B极的电极反应式为_______。
(3)含重金属铬(Ⅵ)的废水具有较强的毒性,离子交换树脂(ROH)法可将有毒废水中的CrO42-和Cr2O72-吸附至树脂上除去,原理如下:2ROH+CrO42-→R2CrO4+2OH-、2ROH+Cr2O72-→R2Cr2O7+2OH- (已知:废水中存在如下平衡:2CrO42-+2H+![]() Cr2O72-+H2O)。
Cr2O72-+H2O)。
控制溶液酸性可以提高树脂对铬(Ⅵ)的去除率,其理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置能达到相应实验目的的是
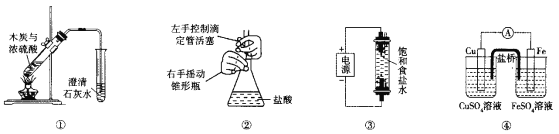
A.装置①用于验证反应是否有CO2生成
B.装置②用于用标准NaOH溶液测定盐酸浓度
C.装置③用于制备少量含NaClO的消毒液
D.装置④用于比较铜、铁活泼性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,由一氧化碳和二氧化碳组成的混合气体为6.72 L,质量为12g,此混合物中一氧化碳和二氧化碳物质的量之比是__________,一氧化碳的体积分数是__________,一氧化碳的质量分数是__________,碳原子和氧原子个数比是__________,混合气体的平均相对分子质量是__________,密度是__________g·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com