
【题目】黄铜矿是工业炼铜的原料,含有的主要元素是硫、铁、铜,请回答下列问题。
(l)基态硫原子中核外电子有____种空间运动状态。Fe2+的电子排布式是 ___。
(2)液态SO2可发生白偶电离2SO2=SO2++SO32-,SO32-的空间构型是 ___,与SO2+互为等电子体的分子有____(填化学式,任写一种)。
(3)CuCl熔点为426℃,融化时几乎不导电,CuF的熔点为908℃,沸点1100℃,都是铜(I)的卤化物,熔沸点相差这么大的原因是 ___。
(4)乙硫醇(C2H5SH)是一种重要的合成中间体,分子中硫原子的杂化形式是____。乙硫醇的沸点比乙醇的沸点____(填“高”或“低”),原因是____。
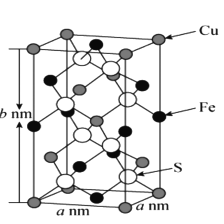
(5)黄铜矿主要成分X的晶胞结构及晶胞参数如图所示,X的化学式是 ___,其密度为 ___g/cm3(阿伏加德罗常数的值用NA表示)。
【答案】16 1s22s22p63s23p63d6(或[Ar]3d6) 三角锥形 N2或CO CuCl为分子晶体,CuF为离子晶体,离子晶体的熔沸点比分子晶体高 sp3 低 乙醇分子间有氢键,而乙硫醇没有 CuFeS2 ![]()
【解析】
(1)硫元素为16号元素,核外有16个电子,9个轨道;铁为26号元素,核外有26个电子,失去最外层的2个电子变成Fe2+;
(2)根据SO32-的杂化方式为sp3确定它的空间结构,由等电子体定义确定SO2+的等电子体的分子;
(3)根据两种晶体的性质确定晶体类型;
(4)根据乙硫醇中硫原子的成键特点判断杂化方式,乙醇分子里有氧,可以形成氢键导致沸点比较高;
(5)根据晶胞结构中Cu、Fe、S原子个数计算出化学式,再由有关公式写出晶胞密度的表达式;
根据以上分析进行解答。
(1)基态原子核外有多少个轨道就有多少个空间运动状态。硫原子的电子排布式为:1s22s22p63s23p4,故硫原子1+1+3+1+3=9个轨道,所以基态硫原子中核外电子有9种空间运动状态;Fe是26号元素,核外有26个电子,铁原子失去最外层的两个电子变成Fe2+,Fe2+的电子排布式是1s22s22p63s23p63d6(或[Ar]3d6)。
答案为:9;1s22s22p63s23p63d6(或[Ar]3d6)。
(2)SO32-离子中的硫原子有三个化学键,一对孤对电子,属于sp3杂化,空间构型为三角锥形;SO2+有两个原子,总价电子数为10,与SO2+互为等电子体的分子有N2、CO等。
答案为:三角锥形;N2或CO。
(3)由题知CuCl熔点为426℃,融化时几乎不导电,可以确定CuCl为分子晶体,熔沸点比较低,CuF的熔点为908℃,沸点1100℃,确定CuF为离子晶体,熔沸点比较高。
答案为:CuCl为分子晶体,CuF为离子晶体,离子晶体的熔沸点比分子晶体高。
(4)乙硫醇(C2H5SH)里的S除了共用的两对电子外还有两对孤对电子要参与杂化,所以形成的是sp3杂化,乙醇里有电负性较强的氧原子,分子间可以形成氢键,沸点比乙硫醇的沸点高。
答案:sp3;低;乙醇分子间有氢键,而乙硫醇没有。
(5)对晶胞结构分析可知,晶胞中的Cu原子数目=8![]() +4
+4![]() +1=4,Fe原子数目=6
+1=4,Fe原子数目=6![]() +4
+4![]() =4,S原子数目为8, X的化学式中原子个数比为:Cu:Fe:S=1:1:2,所以X的化学式为:CuFeS2。
=4,S原子数目为8, X的化学式中原子个数比为:Cu:Fe:S=1:1:2,所以X的化学式为:CuFeS2。
由图可知晶胞内共含4个“CuFeS2”,据此计算:晶胞的质量=4![]() =
=![]() ,晶胞的体积V=anmanmbnm=a2b10-21cm3,所以晶胞的密度=
,晶胞的体积V=anmanmbnm=a2b10-21cm3,所以晶胞的密度=![]() =
=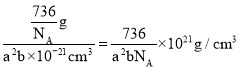 。
。
答案为:CuFeS2;![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.NaCl![]() Cl2(g)
Cl2(g)![]() FeCl2(s)
FeCl2(s)
B.N2(g)![]() NH3(g)
NH3(g)![]() NaHCO3(s)
NaHCO3(s)
C.AgNO3(aq)![]() Ag(NH3)2OH
Ag(NH3)2OH![]() Ag(s)
Ag(s)
D.S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量NaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。
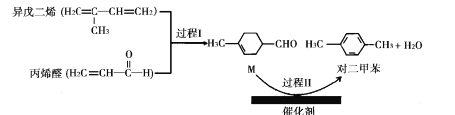
下列说法不正确的是
A.丙烯醛分子中所有原子可能共平面B.可用溴水鉴别异戊二烯和对二甲苯
C.对二甲苯的二氯代物有6种D.M能发生取代,加成,加聚和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积不变的密闭容器中发生反应N2(g)+3H2(g)![]() 2NH3(g),下列叙述表示该反应处于化学平衡状态的是( )
2NH3(g),下列叙述表示该反应处于化学平衡状态的是( )
A.N2、H2、NH3的浓度之比为1∶3∶2
B.混合气体的密度不随时间变化
C.当有1molN≡N键断裂时,有6molN—H键断裂
D.单位时间内生成2amolNH3,同时消耗amolN2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“点击化学”是指快速、高效连接分子的一类反应,例如铜催化的Huisgen环加成反应:

我国科研人员利用该反应设计、合成了具有特殊结构的聚合物F并研究其水解反应。合成线路如下图所示:
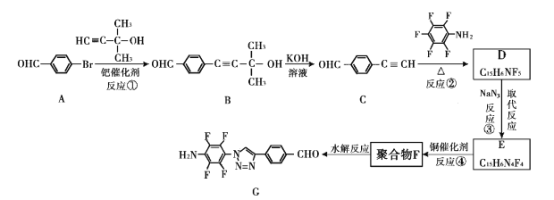
已知:![]()
(1)A生成B的反应类型是____。
(2)关于B和C,下列说法正确的是____(填字母序号)。
a 利用核磁共振氢谱可以鉴别B和C b B不能发生消去反应 c 可用酸性高锰酸钾溶液检验C中含醛基
(3)B生成C的过程中还有另一种生成物X,分子式为C3H6O,核磁共振氢谱显示只有一组峰,X的结构简式为 ___。
(4)反应②的化学方程式为 ___。
(5)请根据以上流程,并推测聚合物F所具有的特殊结构,下列关于聚合物F的结构说法正确的是___
A F中必含 -CH2=N- 结构
B F中必含 -N=N- 结构
C F的结构可能是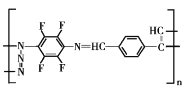
(6)H是比A多一个碳原子的同系物。H的同分异构体中符合下列条件的有 ___种。
①苯环上有三个取代基 ②能和FeCl3发生显色反应
(7)为了探究连接基团对聚合反应的影响,设计了单体K,其合成路线如下,写出H、I、J的结构简式:___
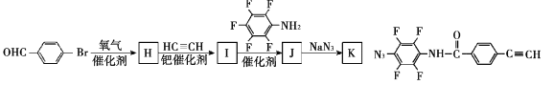
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭烧瓶中,25 ℃时存在着平衡:2NO2(g)![]() N2O4(g)(正反应放热)。把烧瓶置于100 ℃的水中,则下列几项性质中不会改变的是
N2O4(g)(正反应放热)。把烧瓶置于100 ℃的水中,则下列几项性质中不会改变的是
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度
A. ①和③ B. ②和④ C. ④和⑤ D. ③和⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为减少二氧化碳排放,我国科学家设计熔盐电解池捕获二氧化碳的装置,如图所示。下列说法不正确的是
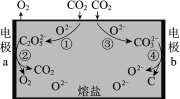
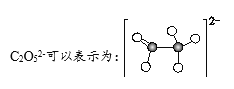
A.过程①中有碳氧键断裂
B.过程②中C2O52-在a极上发生了还原反应
C.过程③中的反应可表示为:CO2+O2- == CO32-
D.过程总反应:CO2![]() C+O2
C+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组的同学根据理论分析后认为,NO2可能会氧化单质铜,他们设想利用下图所示装置验证NO2的氧化性(夹持装置已省略)。
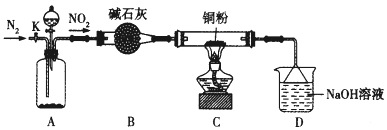
(1)装置A~C中有一处错误,改正的方法是_____________,A中发生反应的两种试剂通常是________。
(2)点燃C处酒精灯比较合适的时机是_____________。若C中固体全部变成黑色,同时生成对环境无污染的气体,写出C中反应的化学方程式:______________。装置D的用途是____________。
(3)开关K的设计是以实现绿色化学实验为目的,请说明K的使用方法______________。(包括使用时段与内容)。
(4)实验结束后发现C中的固体混有少量的红色粉末,经过分析,甲同学认为该红色粉末是Cu2O,乙同学认为该红色粉末是![]() ,丙同学认为该红色粉末是Cu和Cu2O的混合物。查阅资料,Cu、Cu2O和CuO的部分性质如下:
,丙同学认为该红色粉末是Cu和Cu2O的混合物。查阅资料,Cu、Cu2O和CuO的部分性质如下:
稀硫酸 | 氨水 | |
Cu2O | 生成Cu和Cu2+ | 生成无色[Cu(NH3)2]2+ |
CuO | 生成Cu2+ | 生成蓝色[Cu(NH3)4]2+ |
Cu | --- | --- |
请设计一个简单的实验证明甲同学的看法是否正确:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com