
| A.①③④ | B.①②④ | C.①②③④ | D.①②③⑤ |
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源:不详 题型:实验题
| 编号 | 温度/℃ | 加入某盐 | H2SO4体积/mL | H2O体积/mL | 铝粉加入量/g | 铝粉溶解量 /g |
| ① | 20 | 不加 | 40 | 0 | 2.0050 | 0.0307 |
| ② | 80 | 不加 | 40 | 0 | 2.0050 | 0.1184 |
| ③ | t1 | 不加 | 20 | V1 | 2.0050 | ﹨ |
| ④ | t2 | 5 mL0.01 mol·L-1 CuSO4溶液 | 20 | V2 | 2.0050 | ﹨ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g);△H=-92.4kJ?mol-1。下图1是在两种不同实验条件下模拟化工生产进行实验所测得N2随时间变化示意图。
2NH3(g);△H=-92.4kJ?mol-1。下图1是在两种不同实验条件下模拟化工生产进行实验所测得N2随时间变化示意图。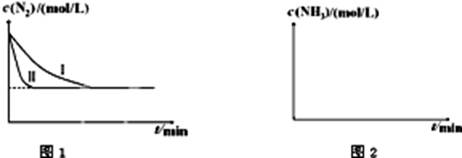
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3是工业上制硫酸的反应。下列关于该反应的说法正确的是( )
2SO3是工业上制硫酸的反应。下列关于该反应的说法正确的是( )| A.减少O2的浓度能加快反应速率 |
| B.降低体系温度能加快反应速率 |
| C.使用催化剂不影响反应速率 |
| D.一定条件下达到反应限度时SO2部分转化为SO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g) △H<0,n(NH3)和n(H2)随时间(t)的变化关系如右图所示。下列分析一定正确的是
2NH3(g) △H<0,n(NH3)和n(H2)随时间(t)的变化关系如右图所示。下列分析一定正确的是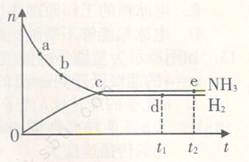
| A.正反应速率:a点小于b点 |
| B.c点处反应达到平衡 |
| C.d点和e点处的n(N2)不一样 |
| D.若其他条件不变,在773 K时反应至t1时刻,n(H2)比图中d点对应的n(H2)大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO(g)+ H2(g)在一容积可变的密闭容器中进行。下列条件的改变对其反应速率几乎无影响的是
CO(g)+ H2(g)在一容积可变的密闭容器中进行。下列条件的改变对其反应速率几乎无影响的是| A.压缩容器体积,增大体系压强 |
| B.加入适当的催化剂 |
| C.保持压强不变,充入惰性气体使容器容积增大 |
| D.保持容器容积不变,充入惰性气体使体系压强增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

 N2(g)+CO2(g),ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+CO2(g),ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时增大压强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g) ΔH<0的速度为v,若降低温度,正反应速率加大
2NH3(g) ΔH<0的速度为v,若降低温度,正反应速率加大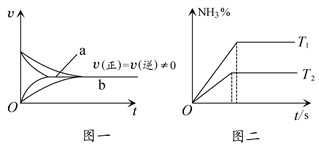
| A.除①⑦外 | B.除③⑤⑥外 | C.除③⑤外 | D.除③⑥⑦外 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com