
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。工业上采用如下工艺流程,从某酸性废液(主要含Cu2+、Fe3+、 H+、Cl-)中制备氯化亚铜。
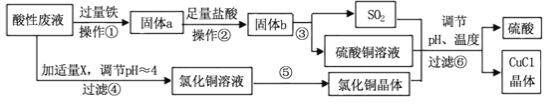
请回答下列问题:
(1)写出步骤①中发生的两个主要反应的离子方程式: 。
(2)步骤②的操作名称是: 。
(3)步骤④中所加物质X为: 。
(4)步骤⑤的操作是: 。
(5)步骤⑥应调节溶液pH呈酸性,且用乙醇洗涤CuCl晶体,目的是: 。
(6)在CuCl的生成过程中,可以循环利用的物质是 ,理论上 (填“是”或“不”)需要补充(不考虑调节等消耗);理由是 。
(7)工业上还可以采用以碳棒为电极电解CuCl2溶液得到CuCl。电解CuCl2溶液,阴极上发生的电极反应式是 。
【答案】(15分)
(1)Cu2++ Fe = Cu+ Fe2+ Fe + 2Fe3+ = 3Fe2+ 或 Fe + 2H+ = Fe2++ H2↑(2分)
(2)过滤、洗涤(不答洗涤也给分)(1分) (3)CuO或Cu (OH) 2 或CuCO3等(2分)
(4)在HCl气流中蒸发结晶(2分)
(5)减少CuCl的损失(答案合理也给分)(2分)
(6)硫酸(或H2SO4)(1分) 不(1分)
Cu与浓硫酸反应生成CuSO4和SO2的物质的量比为1∶1,而生产CuCl的过程中消耗CuSO4和SO2的物质的量比也为1﹕1,所以理论上不需要补充H2SO4(2分)
(7)Cu2++Cl-+e-= CuCl↓ (2分)
【解析】
试题分析:从某酸性废液(主要含Cu2+、Fe3+、H+、Cl-)中制备氯化亚铜,向工业上以某酸性废液(含Cu2+、Fe3+、H+、Cl-)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,酸性废液调节pH值使铁离子沉淀,过滤得氯化铜溶液,氯化铜、硫酸铜、二氧化硫反应生成氯化亚铜和硫酸,硫酸可以再循环利用,
(1)步骤①中铁能与铜离子及铁离子反应生成铜和亚铁离子等,同时铁也与酸性废液中的酸反应生成氢气,涉及的离子方程式为Cu2++Fe=Cu+Fe2+、Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑,故答案为:Cu2++Fe=Cu+Fe2+、Fe+2Fe3+=3Fe2+或Fe+2H+=Fe2++H2↑;
(2)步骤②中从溶液中分离出固体物质过量的铁和生成的铜,所以步骤②的操作名称是过滤、洗涤,故答案为:过滤、洗涤;
(3)步骤④中为调节溶液的pH值,要能与酸反应同时不引入新的杂质,所以物质X为CuO或Cu (OH)2或CuCO3等,故答案为:CuO或Cu (OH)2或CuCO3等;
(4)步骤⑤的操作是从氯化铜溶液中获得氯化铜晶体,要防止铜离子水解,所以步骤⑤的操作是在HCl气流中蒸发结晶,故答案为:在HCl气流中蒸发结晶;
(5)CuCl微溶于水、不溶于乙醇及稀硫酸,所以要用乙醇洗涤CuCl晶体,减少CuCl的损失,故答案为:减少CuCl的损失;
(6)根据流程分析可知,硫酸可以循环利用,Cu与浓硫酸反应生成CuSO4和 SO2的物质的量为1:1,而生产CuCl的过程中消耗CuSO4和SO2的物质的量也为1﹕1,所以理论上不需要补充H2SO4,故答案为:硫酸;否;Cu与浓硫酸反应生成CuSO4和 SO2的物质的量为1:1,而生产CuCl的过程中消耗CuSO4和SO2的物质的量也为1﹕1,所以理论上不需要补充H2SO4;(7)电解CuCl2溶液,阴极上是铜离子得电子生成亚铜离子,亚铜离子结合氯离子生成氯化亚铜沉淀,电极反应式为 Cu2++Cl-+e-=CuCl↓,
故答案为:Cu2++Cl-+e-=CuCl↓.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 硬脂酸甘油酯和乙酸乙酯都属于酯类物质,都能发生皂化反应
B. 制造纸张的原料棉花、制造毛皮大衣的原料皮革,它们的主要成分都是纤维素
C. 在淀粉水解液中加过量NaOH,滴加碘水,如溶液未显蓝色,则证明淀粉水解完全
D. 体积分数75%的乙醇溶液可用于医疗消毒,原理是乙醇使细菌的蛋白质发生变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是
A. 碘单质升华,克服的是其分子间作用力
B. 金刚石、石墨、纳米碳管是碳元素的同素异形体
C. 目前科学家还无法实现对原子或分子的操纵
D. HCl气体溶于水后,共价键被破坏,从而形成了H+和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒在水溶液中大量共存的是
A. Na+、I-、K+、Br2 B. Mg2+、Cu2+、SO42-、NO3-
C. Fe2+、Cl2、K+、SO42- D. ClO-、Cl-、CO2、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义。
I.污染物SO2、NOx经O2预处理后用CaSO3悬浊液吸收,可减少尾气中SO2、NOx的含量。T℃时,O2氧化烟气中SO2、NOx的主要反应的热化学方程式为:
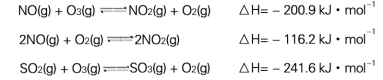
(1) T℃时,反应3NO(g)+O3(g)![]() 3NO2(g)的△H= kJ·mol-1。
3NO2(g)的△H= kJ·mol-1。
(2) T℃时,将0.6 mol NO和0.2 molO3气体充入到2L固定容积的恒温密闭容器中,NO的浓度随反应时间的变化如图1所示。
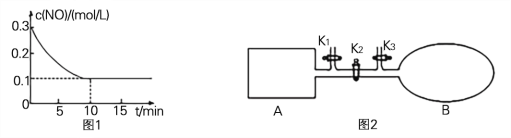
① T℃时,反应3NO(g) +O3 (g) ![]() 3NO2 (g)的平衡常数K= 。
3NO2 (g)的平衡常数K= 。
② 不能说明反应达到平衡状态的是 (填写字母)。
A.气体颜色不再改变 B.气体的平均摩尔质量不再改变
C.气体的密度不再改变 D.单位时间内生成O3和NO2物质的量之比为1∶3
II.NO2的二聚体N2O4是火箭中常用氧化剂。完成下列问题:
(3) 如图2所示,A是由导热材料制成的恒容密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 molNO2通过K1、K3分别充入真空A、B中,反应起始时A、B的体积相同均为aL(忽略导管中的气体体积)。
① 容器A中到达平衡所需时间ts,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)= 。
② 平衡后在A容器中再充入0.5 mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数(填“变大”、“变小”或“不变”) 。
③ 在②平衡后,打开K2,重新到达新平衡,B气囊的体积为0.8aL,则在打开K2之前,气囊B的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把aLAl2(SO4)3和(NH4)2SO4的混合溶液分成两等份,其中一份加入bmolBaCl2,恰好使溶液中的SO42-离子完全沉淀;另一份加入足量强碱并加热可得到c molNH3气体,则原溶液中的Al3+离子的浓度(mol/L)为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人们的生活、健康密切相关.下列做法不合理的是( )
A. 用米汤检验加碘食盐中的碘酸钾(KIO3)
B. 向豆浆中加入盐卤(主要成分为MgCl2)制做豆腐
C. 用灼烧和闻气味的方法区别棉织物和纯毛织物
D. 向污水中加入适量明矾,可除去其中的悬浮物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com