
【题目】把aLAl2(SO4)3和(NH4)2SO4的混合溶液分成两等份,其中一份加入bmolBaCl2,恰好使溶液中的SO42-离子完全沉淀;另一份加入足量强碱并加热可得到c molNH3气体,则原溶液中的Al3+离子的浓度(mol/L)为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
科目:高中化学 来源: 题型:
【题目】图(1、2)是有关氨的制取和性质的实验装置.

(1)仪器C的名称是 ;
(2)写出A中所发生化学反应的化学方程式 ;
(3)收集氨时,试管口棉花的作用 ;
(4)收集氨时,试管B验满的方法是 ;
(5)图1装置还可以制备 气体;
(6)图2装置进行喷泉实验,上部C充满氨气,引发水上喷的操作是 ;所得溶液呈 性(填酸性、碱性或中性),解释原因(用化学方程式表示) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。工业上采用如下工艺流程,从某酸性废液(主要含Cu2+、Fe3+、 H+、Cl-)中制备氯化亚铜。
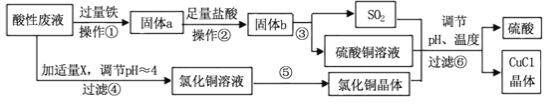
请回答下列问题:
(1)写出步骤①中发生的两个主要反应的离子方程式: 。
(2)步骤②的操作名称是: 。
(3)步骤④中所加物质X为: 。
(4)步骤⑤的操作是: 。
(5)步骤⑥应调节溶液pH呈酸性,且用乙醇洗涤CuCl晶体,目的是: 。
(6)在CuCl的生成过程中,可以循环利用的物质是 ,理论上 (填“是”或“不”)需要补充(不考虑调节等消耗);理由是 。
(7)工业上还可以采用以碳棒为电极电解CuCl2溶液得到CuCl。电解CuCl2溶液,阴极上发生的电极反应式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加罗常数的值,下列叙述正确的是( )
A.在标况下,11.2 L NO与11.2 L O2混合后所含分子数为0.75NA
B.常温常压下,16gO3所含的电子数为8NA
C.5NH4NO3 ![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
D.铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常用离子检验方法有沉淀法:反应中有沉淀产生或溶解;气体法:反应中有气体产生;显色法:反应中有颜色变化.下列离子检验方法不可能涉及沉淀法的是( )
A.NH4+
B.Ca2+
C.I﹣
D.SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列微粒中只有还原性的是( )
A. F-、CO、Na B. Na、I-、Zn
C. Fe2+、SO42-、NO3- D. Fe3+、O2、H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O35H2O,式量248)俗名“大苏打”,又称为“海波”,可用于照相业作定型剂,也可用于纸浆漂白作脱氧剂,它易溶于水,难溶于乙醇,加热、遇酸均易分解,工业上常用亚硫酸钠法、硫化碱法等制备,某实验模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图1:
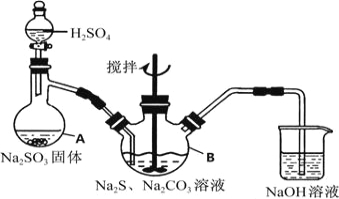
图1
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体均匀的通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸
②直至析出的浑浊不再消失,并控制溶液的PH接近7时,停止通入SO2气体
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O35H2O
④在经过滤、洗涤、干燥.得到所需产品
(1)写出仪器A的名称 ,步骤④中洗涤时,为了减少产物的损失的试剂可以
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液PH<7,请用离子方程式解释原因
(3)最后得到的产品可能含有Na2SO4杂质,请设计实验检测产品中是否存在Na2SO4(已知BaS2O3不溶于水),简要说明实验操作.现象和结论
(4)测定产品纯度
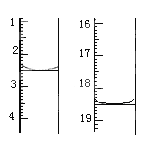
①准确称取1.00g产品,用适量蒸馏水溶解,以淀粉作指示剂用0.1000molL﹣1碘的标准溶液滴定,反应原理为2S2O32﹣+I2=S4O32﹣+2I﹣,滴定起始和终点的滴定管液面位置如图则消耗碘的标准溶液体积为 mL,产品的纯度为 %
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O35H2O的质量分数的测量结果________(填“偏高”“偏低”或“不变”)。
(5)Na2S2O3常用于脱氧剂,在溶液中易被Cl2氧化SO42﹣,该反应的离子方程式为. 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列萃取与分液结合进行的操作(用CCl4为萃取剂,从碘水中萃取碘)中错误的是( )
A.饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡
B.静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体)
C.打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出
D.最后继续打开活塞,另用容器承接并保存上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度氧化铝有广泛的用途,某研究小组用以下流程制取高纯度氧化铝:
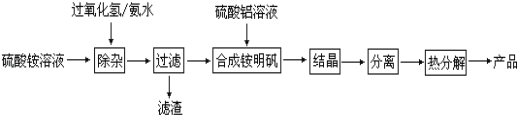
根据上述流程图填空:
(1)“除杂”操作是先加入过氧化氢充分反应后,再用氨水调节溶液的pH,使硫酸铵溶液中的少量Fe2+氧化为Fe3+并进一步转化为Fe(OH)3从而除去Fe2+,则Fe2+酸性条件下氧化为Fe3+的离子方程式为:
(2)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是 。
(3)“分离”操作的名称是 (填字母代号)。
A.蒸馏 B.分液 C.过滤
(4)铵明矾晶体的化学式为NH4Al(SO4)212H2O,铵明矾属于 (填“纯净物”或“混合物”)在0.1mol/L铵明矾的水溶液中,浓度最大的离子是 。
(5)热分解中发生如下反应6NH4Al(SO4)2 = 3Al2O3 + 2NH3 ↑+ 2N2 ↑+ 6SO2 ↑+ 6SO3 ↑+ 9H2O,当生成1mol Al2O3时转移电子物质的量为 mol
(6)往含0.1mol铵明矾稀溶液中逐滴加入含0.3mol Ba(OH)2的稀溶液,反应的总离子方程式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com