
【题目】下列反应既属于氧化还原反应,又是吸热反应的是
A. 锌粒与稀硫酸的反应 B. 灼热的木炭与CO2的反应
C. 甲烷在空气中燃烧的反应 D. Ba(OH)28H2O晶体与NH4Cl晶体的反应
科目:高中化学 来源: 题型:
【题目】实验室制备硅酸的反应为Na2SiO3+2HCl=2NaCl+H2SiO3↓,该反应属于( )
A. 化合反应 B. 复分解反应 C. 分解反应 D. 置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁分析中常用高氯酸(HClO4)溶解矿样,某研究性学习小组欲制备少量高氯酸。该学习小组查阅到:a.HClO4浓度高于60%时遇含碳化合物易爆炸,浓度低于60%时比较稳定;b.NaClO4与浓硫酸反应可制得高氯酸,若采用真空蒸馏可得纯高氯酸;c.NaClO3 在673K(400℃)分解产生NaClO4、NaCl和一种气体。该小组同学设计实验分三步制备高氯酸;(一)制氯气并使制得的氯气与氢氧化钠溶液反应制氯酸纳;(二)氯酸钠分解制高氯酸钠;(三)高氯酸纳与浓硫酸反应制高氯酸[2NaClO4+H2SO4(浓) ![]() Na2SO4+2HClO4 ]。
Na2SO4+2HClO4 ]。
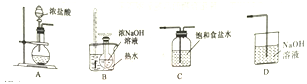
(1)制取氯酸钠的装置连接顺序为A,____________。由装置可知该小组制氯气时采用的氧化剂可以为___________(填化学式)。
(2)B装置中发生反应的离子方程式为_________________________。
(3)为了制备高氯酸钠并推出氯酸钠分解制高氯酸钠的化学方程式,该小组设计了两组装置(甲,乙)如下:

该小组经过分析决定选用甲装置制备高氯酸钠,取NaClO3样品2.13 g,加热充分反应后集气瓶中收集到224 mL(标准状况下)气体,则该反应的化学方程式为_____________________;不选用乙装置的原因可能为____________________。
(4)用丙装置制备高氯酸,向烧瓶中加入高氯酸钠,然后加入浓硫酸后,加热可制取高氯酸。实验开始前,胶塞及导管接口需要包锡箔纸,其原因是_________________,仪器E的名称为________。该组同学发现操作中少加入一种物质,该物质的名称为________。发现后的正确操作为_____________。
(5)工业上大量制备NaClO4 常用高电流密度电解NaClO3 的方法,试写出以惰性电极电解时的阳极反应式:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从冬青中提取出的有机物A可用合合成抗结肠炎药物Y及其他化学品,合成路线如图:

根据上述信息回答:
(1)请写出Y中含氧官能团的名称_________________________。
(2)写出反应③的反应类型:________________________________。
(3)写出反应①的化学方程式:_______________________________________。
(4)A的同分异构体I和J是重要的医药中间体,在浓硫酸的作用下I和J分别生成![]() 和
和![]() ,鉴别I和J的试剂为____________________。
,鉴别I和J的试剂为____________________。
(5)G的同分异构体中,满足下列条件的有_____________种。
①能发生银镜反应 ②能与氯化铁溶液发生显色反应
其中核磁共振氢谱显示四种不同类型的吸收峰。且其峰面积之比为1:2:2:1的结构简 式为____(写一种)。
(6)A的另一种同分异构体K用于合成高分子材料M(![]() ),K 可由L(
),K 可由L(![]() )制得。请写出以L为原料制得M 的合成路线流程图( 无机试剂任用)。流程图示例如下:
)制得。请写出以L为原料制得M 的合成路线流程图( 无机试剂任用)。流程图示例如下:![]() ___________________________
___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃(PMMA)广泛应用于生活。以石油化工产品A为主要原料合成PMMA的一种工艺流程如下(部分产物和条件省略):

(1)B的化学名称为________________。
(2)E的结构简式为________,其核磁共振氢谱显示为________组峰,峰面积之比为________。
(3)由E生成G的反应类型为__________。G中官能团名称为__________。
(4)写出A生成B的化学方程式:_________________________________________________。
(5)T是G的同分异构体,1molT与足量银氨溶液反应最多生成4molAg。T的结构有________种(不含立体结构)。
(6)参照上述流程,以![]() 为原料(其他原料自选),设计合成
为原料(其他原料自选),设计合成![]() 的路线:_______。
的路线:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+,又含有Fe3+,将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4g硫单质,0.425mol FeCl2 和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是
A. 该盐酸的物质的量浓度为4.25mol·L-1
B. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3∶1
C. 成的H2S气体在标准状况下的体积为2.24L
D. 该磁黄铁矿中FexS的x=0.85
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备相关物质,涉及的反应原理及部分流程较为合理的是
A. 制取镁:海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
B. 冶炼铝:铝土矿![]() NaAlO2
NaAlO2![]() 无水AlCl3
无水AlCl3![]() Al
Al
C. 制硝酸:N2、H2 ![]() NH3
NH3![]() NO
NO![]() 50%HNO3
50%HNO3 ![]() 浓HNO3
浓HNO3
D. 海带![]() 海带灰
海带灰![]()
![]() I2(aq)
I2(aq)![]() I2
I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式为:
①C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ/mol
②CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H2=﹣870.3kJ/mol
③H2(g)+ ![]() O2(g)=H2O(l)△H3=﹣285.8kJ/mol
O2(g)=H2O(l)△H3=﹣285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的反应热(焓变)为( )
A.+488.3kJ/mol
B.﹣488.3kJ/mol
C.﹣244.15kJ/mol
D.+244.15kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中有非常丰富的化学资源,从海水中可提取多种化工原料。某工厂对海水资源综合开发利用的部分工艺流程图如下。回答下列问题:

(1)精制食盐水时下列物质中,用到的有______________________(填序号)。
①NaOH溶液 ②盐酸 ③K2CO3溶液 ④BaCl2溶液 ⑤硫酸 ⑥Na2CO3溶液 ⑦Ba(NO3)2溶液
(2)工业上经过②、③、④制备Ba2。步骤②中Cl2氧化Br-应在________(填酸性或碱性)条件下进行;步骤③Br2可用热空气吹出,其原因是_____________________。
(3)为了除去工业Br2中微量的Cl2,可向工业Br2中____________________。
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
(4)若步骤⑤所得Mg(OH)2沉淀中混有Ca(OH)2杂质,写出除去杂质的实验步骤 ________________(写出加入的试剂和操作)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com