
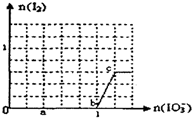
 已知:还原性HSO3?>I?,氧化性IO3?>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )
已知:还原性HSO3?>I?,氧化性IO3?>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )| A、反应过程中的氧化产物均为SO42- |
| B、a点时剩余NaHSO3的物质的量为1.8 mol |
| C、c点时的还原产物可能是KI或NaI |
| D、当溶液中I?与I2的物质的量之比为1:1时,加入的KIO3为1.2mol |
| 0.4mol |
| 1 |
| n |
| 3 |
| 5n |
| 3 |
| 5n |
| 3 |
| 5n |
| 3 |
| 3 |
| 8 |
| n |
| 3 |
| 1 |
| 8 |
| 9 |
| 8 |


科目:高中化学 来源: 题型:
| A、6mol | B、3mol |
| C、4mol | D、5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
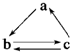 下列所列各组物质中,物质之间通过一步反应就能实现如图转化的是( )
下列所列各组物质中,物质之间通过一步反应就能实现如图转化的是( )| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | CO2 | Na2CO3 | NaHCO3 |
| C | Si | SiO2 | H2SiO3 |
| D | CH2═CH2 | CH3CH2OH | CH3CHO |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁和钢材的主要化学成分相同,性质也相同 |
| B、硬铝(Al-Cu-Mg-Mn-Si合金)制成的门窗耐酸、耐碱、耐高温腐蚀 |
| C、黄铜矿(CuFeS2)可冶炼出Cu、Fe,同时可制取硫酸 |
| D、铁矿石是一种可再生资源,没有必要进行开采限制 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:1 | B、2:3 |
| C、1:4 | D、1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、最外层只有1个电子的元素,一定是金属元素 |
| B、最外层只有2个电子的元素,一定是金属元素 |
| C、原子核外电子层数与最外层电子数相等的元素,一定是金属元素 |
| D、核电荷数为17的元素的原子容易获得1个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com