
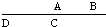 ,C的原子核内的质子数等于A、B原子核内的质子数之和,C等于A+B,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为D原子最外电子层上的电子数的4倍,故D为钠元素,C为硅元素,A为碳元素,结合元素对应化合物的性质解答该题.
,C的原子核内的质子数等于A、B原子核内的质子数之和,C等于A+B,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为D原子最外电子层上的电子数的4倍,故D为钠元素,C为硅元素,A为碳元素,结合元素对应化合物的性质解答该题.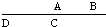 ,C的原子核内的质子数等于A、B原子核内的质子数之和,C等于A+B,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为D原子最外电子层上的电子数的4倍,故D为钠元素,C为硅元素,A为碳元素,
,C的原子核内的质子数等于A、B原子核内的质子数之和,C等于A+B,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为D原子最外电子层上的电子数的4倍,故D为钠元素,C为硅元素,A为碳元素,
| ||
| ||


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
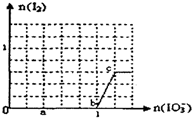 已知:还原性HSO3?>I?,氧化性IO3?>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )
已知:还原性HSO3?>I?,氧化性IO3?>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )| A、反应过程中的氧化产物均为SO42- |
| B、a点时剩余NaHSO3的物质的量为1.8 mol |
| C、c点时的还原产物可能是KI或NaI |
| D、当溶液中I?与I2的物质的量之比为1:1时,加入的KIO3为1.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、共价化合物一定都是由非金属构成 |
| B、含有共价键的化合物都是共价化合物 |
| C、HCl=H++Cl-,故HCl是离子化合物 |
| D、凡是含有离子键的化合物都是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com