
2 1 |
3 1 |
2 1 |
3 1 |
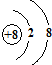 ,故答案为:
,故答案为: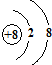 ;
;

科目:高中化学 来源: 题型:
| A、最外层只有1个电子的元素,一定是金属元素 |
| B、最外层只有2个电子的元素,一定是金属元素 |
| C、原子核外电子层数与最外层电子数相等的元素,一定是金属元素 |
| D、核电荷数为17的元素的原子容易获得1个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
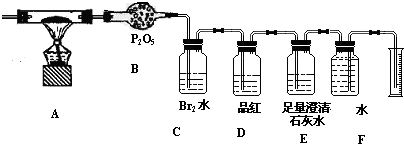
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/浓度 | C(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | A | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.3 | 1.6 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
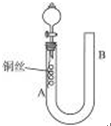 为了说明稀硝酸与铜反应产生无色的一氧化氮气体,某同学设计了如图所示的实验装置,实验时,将分液漏斗的活塞打开,从U形管的长管口注入稀硝酸,一直到U形管的短管口单孔塞下沿且液面上不再留有气泡为止.关闭活塞,并用酒精灯在U形管短管下微热.当铜丝上有气泡产生时,立即撤去酒精灯.
为了说明稀硝酸与铜反应产生无色的一氧化氮气体,某同学设计了如图所示的实验装置,实验时,将分液漏斗的活塞打开,从U形管的长管口注入稀硝酸,一直到U形管的短管口单孔塞下沿且液面上不再留有气泡为止.关闭活塞,并用酒精灯在U形管短管下微热.当铜丝上有气泡产生时,立即撤去酒精灯.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com