
【题目】如图烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是( )
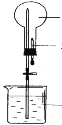
A.a为HCl,b为H2O
B.a为SO2,b为浓NaOH溶液
C.a为NH3,b为稀盐酸
D.a为Cl2,b为饱和NaCl溶液
【答案】D
【解析】
烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则气体a极易溶于水,或极易与烧杯中的液体反应,导致气体减少,构成压强差,从而形成喷泉,以此来解答。
A.HCl极易溶于水,构成压强差,可形成喷泉,A选项正确;
B.SO2可与浓NaOH反应,导致气体减少,构成压强差,从而形成喷泉,B选项正确;
C.氨气极易溶于水,可与盐酸反应生成NH4Cl溶液,导致气体减少,构成压强差,可形成喷泉,C选项正确;
D.Cl2微溶于水,饱和NaCl溶液可降低其在水中的溶解度,抑制氯气的溶解,不能形成压强差,则不能形成喷泉,D选项错误;
答案选D。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】在一体积为2L的密闭容器中A、B两种气体反应生成C、D两种气体的可逆反应3A+B![]() xC+2D的体系中,若一开始在体系中冲入3molA和3molB气体,2min末反应达到平衡状态,生成1molD,并测得C的浓度为0.5mol/L。由此推断:
xC+2D的体系中,若一开始在体系中冲入3molA和3molB气体,2min末反应达到平衡状态,生成1molD,并测得C的浓度为0.5mol/L。由此推断:
(1)x值等于___。
(2)平衡时B的浓度为___。
(3)生成D的反应速率___。
(4)试计算反应前和平衡时气体压强之比为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着社会经济的发展,汽车已进入千家万户,它给人们出行带来方便的同时汽车尾气污染问题也日益突显,汽车尾气中含![]() 和固体悬浮颗粒等。用活性炭还原处理氮氧化物是一种实用的氮氧化物转化方法:
和固体悬浮颗粒等。用活性炭还原处理氮氧化物是一种实用的氮氧化物转化方法:![]() ,可实现氮氧化物无害转化。下列环境问题与汽车尾气的大量排放无关的是( )
,可实现氮氧化物无害转化。下列环境问题与汽车尾气的大量排放无关的是( )
A.酸雨B.温室效应C.PM 2.5超标D.白色污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Fe3+、Fe2+性质实验的说法错误的是

A. 用上图装置可以制备沉淀Fe(OH)2
B. 配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度
C. FeCl3溶液中滴加KSCN溶液会生成红色沉淀
D. 向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿石含碳酸镁和石英,制备高纯硅和硅胶的工艺流程如下:

(1)“硅胶”冶常用作_______________ ,也可以用作__________的载体。 A 的结构式为________。
(2)制备粗硅的方程式为_______。
(3)操作I为_____________,操作Ⅱ为_______________,操作Ⅲ所用仪器有铁架台(带铁圈)、酒精灯、_______________等。
(4)操作Ⅲ,需要在氯化氢气流中加热脱水的原因是_______________。
(5)溶液G用E酸化的方程式为_______________。
(6)电解饱和的K溶液的离子方程式为____________,阳极电极方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组物质中:A.O2和O3 B.12C和13C C.H2O和D2O
___组两物质互为同位素;___组两物质互为同素异形体。
(2)工业上用![]() 做原料制取硝酸,要经过三步主要反应,请写出第二步和第三步反应的化学方程式。
做原料制取硝酸,要经过三步主要反应,请写出第二步和第三步反应的化学方程式。
第一步反应:4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
第二步反应:___;
第三步反应:___。
(3)把下列现象中硫酸所表现出来的性质填写在空白处。
用稀硫酸清洗铁锈___;
放置在敞口烧杯中的浓硫酸质量增加__;
浓硫酸滴在纸上时,纸变黑。__;
把铜片放入热的浓硫酸中时,有气体放出。___。
(4)用序号填空,下列物质中:①PH3 ②H2O2 ③Na2O2 ④KOH ⑤(NH4)2SO4 ⑥F2
只含共价键的是___;既含离子键又含极性键的是___;既含离子键又含非极性键的是___。
(5)下列反应中,属于放热反应的有___(填序号)。
①煅烧石灰石(主要成分是CaCO3)制生石灰(CaO)
②Ba(OH)2·8H2O和NH4Cl晶体的反应
③炸药爆炸
④酸与碱的中和反应
⑤生石灰与水作用制熟石灰
⑥食物因氧化而腐败
⑦乙醇燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组为了验证元素非金属性递变规律,设计了如图所示的两套实验方案进行实验探究:
方案一:
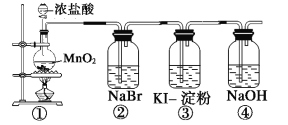
(1)根据方案一装置回答以下问题:
写出装置①发生的化学反应方程式:___。若将反应后②中的溶液倒入苯中,振荡静置后,出现的现象与如图吻合的是___。(填代号)装置③中的现象是___。

(2)根据方案二装置回答以下问题:
方案二:

方案二验证元素非金属性递变的理论依据是:___。B装置的作用是___,X试剂是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上烟气脱氮的原理NO(g)+NO2(g)+2NH3(g)![]() 2N2(g)+3H2O(g)+Q(Q>0)
2N2(g)+3H2O(g)+Q(Q>0)
(1)该反应化学平衡常数K的表达式为___。如果平衡常数K值增大,对___(填“正反应”或“逆反应”)的速率影响更大。
(2)若反应在恒容条件下进行,能说明反应已经达到平衡状态的是___(填序号)
a.容器内混合物的质量不变 b.容器内气体的压强不变
c.反应消耗0.5molNO的同时生成1molN2 d.NO2的浓度不变
(3)向2L密闭容器中加入反应物,10 min后达到平衡,测得平衡时氮气物质的量增加了0.2mol,则用H2O(g)表示的平均反应速率为___。
(4)如图是P1压强下NO的转化率随反应时间(t)的变化图,请在图中画出其他条件不变情况下,压强为P2(P2>P1)下NO的转化率随反应时间变化的示意图。___

(5)写出反应物中的氨气的电子式___;其空间构型为__;它常用来生产化肥NH4Cl。NH4Cl溶液显___性;常温下将等体积等浓度的氨水和NH4Cl溶液混合,pH>7,溶液中NH3·H2O、H+、OH-、NH4+、Cl-浓度由大到小的关系是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com