
【题目】10mL1mol·L-1的盐酸与过量的锌粉反应,若加入少量的下列物质,能减慢反应速率但又不影响氢气生成量的是
A.CuSO4(s)B.CH3COONa(s)C.KNO3(aq)D.Na2CO3(aq)
 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图
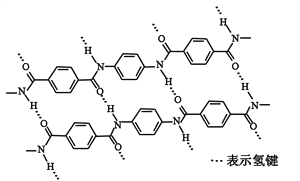
下列关于该高分子的说法正确的是
A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B. 完全水解产物的单个分子中,含有官能团―COOH或―NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
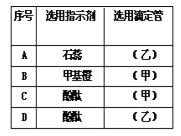
【题目】某研究性学习小组的学生用标准浓度的氢氧化钠溶液测定未知浓度的盐酸溶液。
(1)该学生指示剂和装标准液的仪器选用正确的一组是___(写编号)

(2)该同学滴定操作的正确顺序是(用序号填写):( )→( )→d→( )→( )→( )→f___
a.用酸式滴定管取盐酸溶液25.00mL,注入锥形瓶中,加入指示剂
b.用蒸馏水洗干净滴定管
c.用待测定的溶液润洗酸式滴定管
d.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度"0"以上2~3 cm处,再把碱式滴定管固定好,调节液面至度"0"或“0”刻度以下
e.检查滴定管是否漏水。
f.另取锥形瓶,再重复操作一次
g.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
(3)实验中用左手控制___(填仪器及部位),眼睛注视__,直至滴定终点。判断到达终点的现象是__。
(4)已知滴定管中装有浓度为0.1000mol/L的氢氧化钠.逐滴加入到装有盐酸溶液的锥形瓶中。开始时读数及恰好反应时氢氧化钠溶液的读数见表。
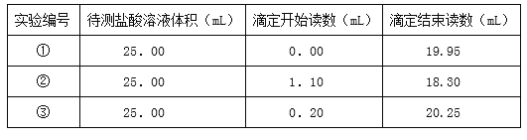
请计算待测的盐酸的物质的量浓度___。
(5)下面操作会导致待测盐酸的浓度偏大的是___(写编号)。
a.其它操作均正确,滴定终点读数时,仰视滴定管的刻度
b.盛装待测液的锥形瓶用水洗后未用所装待测液润洗
c.盛装标准液的碱式滴定管未用标准液洗
d.盛装待测液的酸式滴定管未用待测液润洗
e.配制标准溶液时,称取的NaOH固体中含少量KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.激素类药物乙烯雌酚的结构简式为: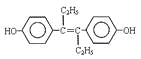 ,它的分子式是:C18H20O2
,它的分子式是:C18H20O2
B.等质量的甲烷、乙烯、乙醇分别充分燃烧,所耗用氧气的量依次减少
C.聚乳酸(![]() )是由单体之间通过加聚反应合成的
)是由单体之间通过加聚反应合成的
D.实验证实![]() 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键
可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4L四氯化碳的分子数约为NA
B.氢氧燃料电池正极消耗22.4L(标准状况)气体时,则线路通过电子数目为2NA
C.将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
D.惰性电极电解足量CuSO4溶液,若加入0.1molCuO可以复原,则电解时转移电子数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3的性质说法正确的是
A. 溶解度:Na2CO3>NaHCO3
B. 右图所示装置可证明稳定性:Na2CO3>NaHCO3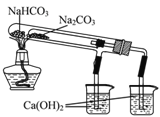
C. 用澄清石灰水可鉴别Na2CO3溶液和NaHCO3溶液
D. 等质量的Na2CO3和NaHCO3分别与过量盐酸反应,放CO2质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO具有还原性,不与碱反应,可以被过氧化钠吸收。某化学兴趣小组为了研究NO与Na2O2反应,通过如图所示装置进行实验。
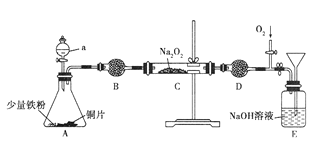
(1)仪器B的名称是_________________,其中填充的是___________________,作用为___________________________________________________________。
(2)从分液漏斗中加稀硝酸之前,先加入少量稀硫酸,目的是__________________。
(3)实验观察到C中固体颜色变白,该兴趣小组通过进一步实验证明C中生成的白色固体为NaNO2, C中反应的化学方程式为_______________________________。
(4)实验开始后需打开活塞,通入氧气,E中观察到的主要现象为_______________;NaOH溶液的作用是____________________________,若最终E中溶液只有一种溶质,发生的总反应方程式是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁用于照明弹,是因为镁能在空气中燃烧产生耀眼光芒,并发生如下三个反应:
①2Mg+O2![]() 2MgO
2MgO
②3Mg+N2![]() Mg3N2
Mg3N2
③2Mg+CO2![]() 2MgO+C(黑色)。
2MgO+C(黑色)。
关于上述三个反应的叙述不正确的是( )
A.反应①②③的还原剂都是金属镁
B.反应①和③中都是氧元素被还原
C.反应②的生成物中氮元素为-3价
D.反应③的氧化剂是二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某活动课程小组拟用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入过量的CO2气体生成NaHCO3,设计了如下实验步骤:
a.取25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸溶液1~2 min,赶走溶解在溶液中的CO2气体;
c.在得到的溶液中加入另一半(25 mL)NaOH溶液,使其充分混合反应。
(1)此方案能制得较纯净的Na2CO3,写出c步骤的离子方程式_________。此方案第一步的实验装置如图所示:
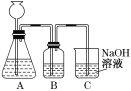
(2)加入反应物前,如何检验整个装置的气密性:___________。
(3)若用大理石与盐酸制CO2,则装置B中盛放的试剂是___________,作用是:_________。
(4)在实验室通常制法中,装置A还可作为下列_________(填序号)气体的发生装置。
①HCl ②H2 ③Cl2
(5)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44 g/mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为_____mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com