
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4L四氯化碳的分子数约为NA
B.氢氧燃料电池正极消耗22.4L(标准状况)气体时,则线路通过电子数目为2NA
C.将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
D.惰性电极电解足量CuSO4溶液,若加入0.1molCuO可以复原,则电解时转移电子数目为0.2NA
【答案】D
【解析】
A.四氯化碳在标况下不为气体,不能由公式![]() 进行计算,A项错误;
进行计算,A项错误;
B.氢氧燃料电池的正极消耗的是氧气,22.4L标况下的O2,由公式![]() 可知即为1mol;1molO2能够转移4mol电子,B项错误;
可知即为1mol;1molO2能够转移4mol电子,B项错误;
C.Cl2通入水中发生可逆反应:![]() ,HCl在水中完全解离,HClO在水中部分解离,因此溶液中:
,HCl在水中完全解离,HClO在水中部分解离,因此溶液中:![]() ,C项错误;
,C项错误;
D.加入0.1molCuO电解后的溶液得以复原,说明电解过程中消耗的+2价Cu0.1mol,-2价O也是0.1mol;电解硫酸铜溶液时,+2价Cu得电子被还原变成铜单质,-2价O被氧化转化为O2,根据得失电子守恒计算可知,电解时转移电子的数目即为0.2NA,D项正确;
答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已,知:R-C≡C-H+R'Br ![]() R-C≡C-R'+HBr (R,R'+表示氢原子或羟基),利用该反应合成导电高分子材料P的结构式
R-C≡C-R'+HBr (R,R'+表示氢原子或羟基),利用该反应合成导电高分子材料P的结构式![]() 。下列说法正确的是
。下列说法正确的是
A. ![]() 和苯乙炔互为同系物
和苯乙炔互为同系物
B. 炔烃和卤代烃在一定条件下可发生取代反应
C. 高分子材料P不能使溴的四氯化碳溶液褪色
D. 生成P的单体是![]() 和CH3Br
和CH3Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法不正确的是
A.常温下将5.6 g 铁加到足量浓硫酸中,转移电子数为0.3 NA
B.常温常压下,28 g丙烯中所含C-H键的数目为4 NA
C.1 L 3.0 mol·L-1的 NH4Cl溶液中,NH4+ 数目小于3 NA
D.2.0 g重水 (D2O) 中含有的中子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】有机玻璃是一种高分子化合物,在工业上和生活中有着广泛用途,工业上合成有机玻璃流程为:

下列说法不正确的是
A. 反应①的原子利用率达100%
B. 反应②是加聚反应
C. 相对分子质量为86,且与甲基丙烯酸甲酯具有相同官能团的有机物有5种
D. 甲基丙烯酸甲酯能使酸性高锰酸钾褪色,也能使Br2/CCl4褪色,二者原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质之间有如下反应关系:
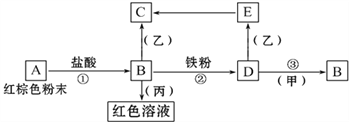
已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。
回答:
(1) 写出下列物质的化学式:A______B______D________甲_______乙_______丙__________
(2) 写出E→C反应的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10mL1mol·L-1的盐酸与过量的锌粉反应,若加入少量的下列物质,能减慢反应速率但又不影响氢气生成量的是
A.CuSO4(s)B.CH3COONa(s)C.KNO3(aq)D.Na2CO3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计以下装置进行实验:
(1)按如图所示装置进行实验,填写有关现象及化学方程式。

①B中浓硫酸的作用是__________________________________。
②C中发生反应的化学方程式为______________________________________________________。
③D中的现象是___________________________________________。
(2)用如图所示装置制取纯净的O2。

①若C是一种淡黄色固体,则烧瓶中发生反应的化学方程式是______________________。
②若C是一种黑色粉末,则B物质是________,C物质的作用是__________________。
③洗气瓶(广口瓶)中装的试剂D是________,其作用是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列表格
序号 | 物质 | 分子数(用NA表示) | 质量/g | 物质的量/mol | 摩尔质量/g·mol-1 | 体积/标况 |
(1) | 氮气 | ___ | 14 | ___ | ___ | ___ |
(2) | H2SO4 | 3.01×1022 | ___ | ___ | ___ | 空 |
(3) | H2O | ___ | ___ | 0.5 | ___ | 空 |
(4) | Cl2 | ___ | ___ | ___ | ___ | 2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氧化(NiOOH)可用废镍催化剂(主要含Ni、Al,少量Cr、FeS等)来制备,其工艺流程如下:
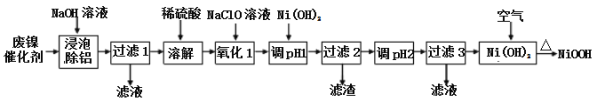
回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_____________________。
(2)“过滤1”用到的玻璃仪器________________________________________。
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为_______________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式________________。
(5)在酸性溶液中CrO![]() 可以转化成Cr2O
可以转化成Cr2O![]() ,用离子方程式表示该转化反应__________,已知BaCrO4的Ksp=1.2×10-10,要使溶液中CrO
,用离子方程式表示该转化反应__________,已知BaCrO4的Ksp=1.2×10-10,要使溶液中CrO![]() 沉淀完全(c(CrO
沉淀完全(c(CrO![]() )≦1×10-5mol·L1),溶液中钡离子浓度至少为________mol·L1。
)≦1×10-5mol·L1),溶液中钡离子浓度至少为________mol·L1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com