
【题目】碱式氧化(NiOOH)可用废镍催化剂(主要含Ni、Al,少量Cr、FeS等)来制备,其工艺流程如下:
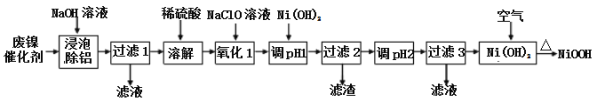
回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_____________________。
(2)“过滤1”用到的玻璃仪器________________________________________。
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为_______________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式________________。
(5)在酸性溶液中CrO![]() 可以转化成Cr2O
可以转化成Cr2O![]() ,用离子方程式表示该转化反应__________,已知BaCrO4的Ksp=1.2×10-10,要使溶液中CrO
,用离子方程式表示该转化反应__________,已知BaCrO4的Ksp=1.2×10-10,要使溶液中CrO![]() 沉淀完全(c(CrO
沉淀完全(c(CrO![]() )≦1×10-5mol·L1),溶液中钡离子浓度至少为________mol·L1。
)≦1×10-5mol·L1),溶液中钡离子浓度至少为________mol·L1。
【答案】2Al+2OH-+2H2O==2AlO2-+3H2↑ 烧杯、漏斗、玻璃棒 5.6~6.2 4Ni(OH)2+O2![]() 4NiOOH+2H2O 2CrO42-+2H+
4NiOOH+2H2O 2CrO42-+2H+![]() Cr2O72-+H2O 1.2×10-5mol·L1
Cr2O72-+H2O 1.2×10-5mol·L1
【解析】
由流程可知,废镍催化剂(主要含Ni、Al,少量Cr、FeS等)加氢氧化钠碱浸,Al溶于氢氧化钠溶液 2Al+2NaOH+2H2O═2NaAlO2+3H2↑,过滤得到固体含有Ni、Cr、FeS,加入稀硫酸酸浸溶解,溶液含有Ni2+、Fe2+、Cr2+,加入NaClO氧化亚铁离子为铁离子,加入Ni(OH)2调节溶液pH使Fe3+和Cr2+全部沉淀,镍离子不沉淀,过滤后调节溶液pH得到Ni(OH)2沉淀,通过蒸发浓缩,冷却结晶,过滤洗涤得到NiSO47H2O晶体,在加热条件下与空气反应得到碱式氧化镍(NiOOH),据此分析解答。
(1)“浸泡除铝”时,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑。本小题答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑。
(2) “过滤1”用到的玻璃仪器烧杯、漏斗、玻璃棒。本小题答案为:烧杯、漏斗、玻璃棒。
(3)加入Ni(OH)2调节溶液pH 1使Fe3+和Cr2+全部沉淀,镍离子不沉淀,故pH范围为5.66.2。本小题答案我为:5.66.2。
(4)在加热条件下Ni(OH)2与空气反应得到碱式氧化镍(NiOOH),化学方程式为:4Ni(OH)2+O2![]() 4NiOOH+2H2O。本小题答案为:4Ni(OH)2+O2
4NiOOH+2H2O。本小题答案为:4Ni(OH)2+O2![]() 4NiOOH+2H2O。
4NiOOH+2H2O。
(5) 在酸性溶液中CrO![]() 可以转化成Cr2O
可以转化成Cr2O![]() ,根据原子守恒和电荷守恒,该反应的离子方程式为:2CrO42-+2H
,根据原子守恒和电荷守恒,该反应的离子方程式为:2CrO42-+2H![]() +Cr2O72-+H2O。已知BaCrO4的Ksp=1.2×10-10,要使溶液中CrO42-沉淀完全(c(CrO72-)≦1×10-5mol·L1),根据沉淀溶解平衡可知Ksp=
+Cr2O72-+H2O。已知BaCrO4的Ksp=1.2×10-10,要使溶液中CrO42-沉淀完全(c(CrO72-)≦1×10-5mol·L1),根据沉淀溶解平衡可知Ksp=![]() ,则1.2×10-10=1×10-5mol·L1×c(Ba2+),则c(Ba2+)= 1.2×10-5mol·L1。本小题答案为:2CrO42-+2H
,则1.2×10-10=1×10-5mol·L1×c(Ba2+),则c(Ba2+)= 1.2×10-5mol·L1。本小题答案为:2CrO42-+2H![]() +Cr2O72-+H2O;1.2×10-5mol·L1。
+Cr2O72-+H2O;1.2×10-5mol·L1。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4L四氯化碳的分子数约为NA
B.氢氧燃料电池正极消耗22.4L(标准状况)气体时,则线路通过电子数目为2NA
C.将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
D.惰性电极电解足量CuSO4溶液,若加入0.1molCuO可以复原,则电解时转移电子数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示装置回答以下问题。已知:①KMnO4常温下与浓盐酸反应可制得Cl2。②H2SiO3不溶于水。
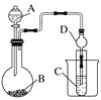
(1)利用如图装置可以验证元素非金属性的变化规律。图中A装置的名称是________________。干燥管D的作用是____________。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性强于硫:烧瓶中发生反应的离子方程式为____________________________。装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_____________________。
(3)若要用此装置证明酸性:HNO3>H2CO3>H2SiO3,进而证明非金属性:N>C>Si,从以下所给物质中选出甲同学设计的实验所用到的物质:①稀HNO3 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2。试剂A与C分别为________(填序号);试管中发生反应的离子方程式为__________________。有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3是一种化工原料,可以通过反应生成一系列物质,如图所示。
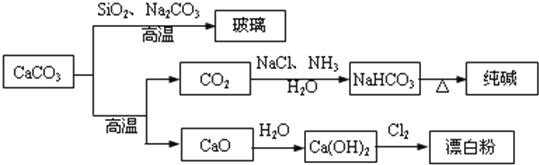
下列说法正确的是( )
A.![]() 和
和![]() 均可以漂白有色物质,且漂白的原理相同
均可以漂白有色物质,且漂白的原理相同
B.由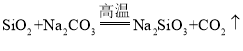 可知
可知![]() 的酸性强于
的酸性强于![]()
C.工业上,可先向饱和食盐水中通入![]() 后再通入
后再通入![]() 制
制![]()
D.制取玻璃、纯碱和漂白粉所涉及的反应都是非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多晶硅是单质硅的一种形态,是制造硅抛光片、太阳能电池及高纯硅制晶的主要原料。已知多晶硅第三代工业制取流程如图所示:
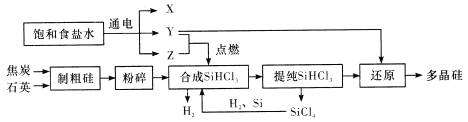
下列说法错误的是
A. Y、Z分别为H2、Cl2
B. 制取粗硅的过程中焦炭与石英会发生副反应生成碳化硅,在该副反应中,氧化剂与还原剂的物质的量之比为1:1
C. SiHCl3极易水解,其完全水解的产物为H2SiO3、H2、HCl,据此推测SiHCl3中硅元素的化合价为+2价
D. Y与SiHCl3制备多晶硅的反应属于置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某活动课程小组拟用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入过量的CO2气体生成NaHCO3,设计了如下实验步骤:
a.取25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸溶液1~2 min,赶走溶解在溶液中的CO2气体;
c.在得到的溶液中加入另一半(25 mL)NaOH溶液,使其充分混合反应。
(1)此方案能制得较纯净的Na2CO3,写出c步骤的离子方程式_________。此方案第一步的实验装置如图所示:
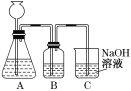
(2)加入反应物前,如何检验整个装置的气密性:___________。
(3)若用大理石与盐酸制CO2,则装置B中盛放的试剂是___________,作用是:_________。
(4)在实验室通常制法中,装置A还可作为下列_________(填序号)气体的发生装置。
①HCl ②H2 ③Cl2
(5)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44 g/mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为_____mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知12.04×1023个O2分子,则O2的物质的量是________。已知CO2的质量是88g,则CO2的物质的量是________。标准状况下,已知N2的体积是11.2L,则N2的物质的量是________。将4.0gNaOH溶于蒸馏水中,配成2L溶液,则溶质的物质的量浓度是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com