
【题目】CaCO3是一种化工原料,可以通过反应生成一系列物质,如图所示。
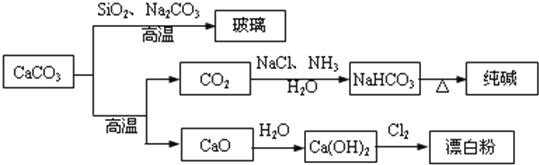
下列说法正确的是( )
A.![]() 和
和![]() 均可以漂白有色物质,且漂白的原理相同
均可以漂白有色物质,且漂白的原理相同
B.由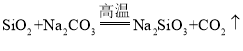 可知
可知![]() 的酸性强于
的酸性强于![]()
C.工业上,可先向饱和食盐水中通入![]() 后再通入
后再通入![]() 制
制![]()
D.制取玻璃、纯碱和漂白粉所涉及的反应都是非氧化还原反应
【答案】C
【解析】
A项、二氧化硫与有机色质化合为无色物质,具有漂白性,而Cl2没有漂白性,其与水反应生成的HClO,具有强氧化性,可以使有色物质褪色,具有漂白性,故A错误;
B项、反应在高温条件下进行,不是利用强酸制备弱酸原理,不能说明酸性强弱,故B错误;
C项、NH3极易溶于水且溶液呈弱减性,再通入CO2使之更多地转化为HCO3-,故工业上,可先向饱和食盐水中通入NH3后再通入CO2制NaHCO3,故C正确;
D项、二氧化硅与碳酸钠反应制取玻璃、加热分解碳酸氢钠制取纯碱,两反应中元素化合价不变化,属于非氧化还原反应,但制备漂白粉的反应中氯元素的化合价由0价变化为-1、+1价,属于氧化还原反应,故D错误;
故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】【题目】有机玻璃是一种高分子化合物,在工业上和生活中有着广泛用途,工业上合成有机玻璃流程为:

下列说法不正确的是
A. 反应①的原子利用率达100%
B. 反应②是加聚反应
C. 相对分子质量为86,且与甲基丙烯酸甲酯具有相同官能团的有机物有5种
D. 甲基丙烯酸甲酯能使酸性高锰酸钾褪色,也能使Br2/CCl4褪色,二者原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列表格
序号 | 物质 | 分子数(用NA表示) | 质量/g | 物质的量/mol | 摩尔质量/g·mol-1 | 体积/标况 |
(1) | 氮气 | ___ | 14 | ___ | ___ | ___ |
(2) | H2SO4 | 3.01×1022 | ___ | ___ | ___ | 空 |
(3) | H2O | ___ | ___ | 0.5 | ___ | 空 |
(4) | Cl2 | ___ | ___ | ___ | ___ | 2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生态工业园区的建设,不仅仅是体现环保理念,重要依据循环经济理论和充分考虑经济的可持续发展,如图是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产生三大生态产业链流程图。根据上述产业流程回答下列问题:
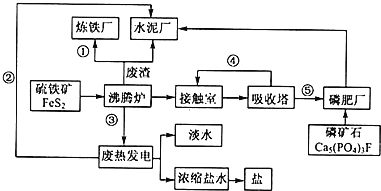
(1)从原料、能源、交通角度考虑该企业应建在______
A西部山区 B沿海地区 C发达城市 D东北内陆
(2)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式:①______、②______、③______、④______、⑤______。
(3)沸腾炉发生反应的化学方程式:______;磷肥厂的主要产品是普钙,其主要成分是______(填化学式)。
(4)热电厂的冷却水是______,该流程中浓缩盐水除提取盐以外还可提取的物质有______(写出一种即可)。
(5)根据现代化工厂没计理念请提出高炉炼铁厂废气、废渣及多余热能的利用设想。______,______(写出两点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为3∶1)直接作燃料,其工作原理如图所示,并以此电源用于工业生产。
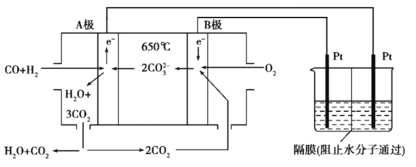
(1)H2(g)、CO(g)的燃烧热ΔH分别为-285.8kJ·mol-1、-283.0kJ·mol-1,1g液态水变为水蒸气时吸热2.44kJ,则电池总反应3CO(g)+H2(g)+2O2(g)=3CO2(g)+H2O(g)的ΔH=___________kJ·mol-1,B电极上发生反应的电极反应式为___________。
(2)若以此电源生产新型硝化剂N2O5,装置如上图所示。已知两室加入的试剂分别是a.硝酸溶液b.N2O4+无水硝酸,则左室加入的试剂应为___________(填“a”或“b”),其电极反应式为___________。
(3)若以此电源用惰性电极电解足量的硝酸银溶液,阴极产物的质量为5.4g,则阳极产生的气体在标准状况下的体积为___________L。电解后溶液体积为500mL,溶液的pH约为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.已知:①C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1;②2CO(g)+O2(g)=2CO2(g) ΔH2=-566kJ·mol-1;③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH3=+141kJ·mol-1;则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=2ΔH1-ΔH2+ΔH3
B.有机物M经过太阳光光照可转化成N,ΔH=+88.6kJ·mol-1。则N比M更稳定
C.已知拆开1molH—H键,1molN—H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2(g)与H2(g)反应生成NH3(g)的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.0kJ·mol-1
2NH3(g) ΔH=-92.0kJ·mol-1
D.已知CH3OH(l)的燃烧热ΔH=-726.5kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-akJ·mol-1则a<726.5
O2(g)=CO2(g)+2H2(g) ΔH=-akJ·mol-1则a<726.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氧化(NiOOH)可用废镍催化剂(主要含Ni、Al,少量Cr、FeS等)来制备,其工艺流程如下:
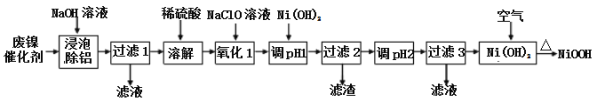
回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_____________________。
(2)“过滤1”用到的玻璃仪器________________________________________。
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为_______________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式________________。
(5)在酸性溶液中CrO![]() 可以转化成Cr2O
可以转化成Cr2O![]() ,用离子方程式表示该转化反应__________,已知BaCrO4的Ksp=1.2×10-10,要使溶液中CrO
,用离子方程式表示该转化反应__________,已知BaCrO4的Ksp=1.2×10-10,要使溶液中CrO![]() 沉淀完全(c(CrO
沉淀完全(c(CrO![]() )≦1×10-5mol·L1),溶液中钡离子浓度至少为________mol·L1。
)≦1×10-5mol·L1),溶液中钡离子浓度至少为________mol·L1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分被氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.92 g,经如下处理:

下列说法正确的是①滤液A中的阳离子为Fe2+、Fe3+、H+ ;②样品中氧元素的物质的量为0.03 mol;③溶解样品的过程中消耗硫酸的总物质的量为0.04 mol;④V=224;⑤V=336。
A. ①③④ B. ②③④ C. ②③⑤ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com