
【题目】下列说法错误的是( )
A.已知:①C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1;②2CO(g)+O2(g)=2CO2(g) ΔH2=-566kJ·mol-1;③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH3=+141kJ·mol-1;则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=2ΔH1-ΔH2+ΔH3
B.有机物M经过太阳光光照可转化成N,ΔH=+88.6kJ·mol-1。则N比M更稳定
C.已知拆开1molH—H键,1molN—H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2(g)与H2(g)反应生成NH3(g)的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.0kJ·mol-1
2NH3(g) ΔH=-92.0kJ·mol-1
D.已知CH3OH(l)的燃烧热ΔH=-726.5kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-akJ·mol-1则a<726.5
O2(g)=CO2(g)+2H2(g) ΔH=-akJ·mol-1则a<726.5
【答案】B
【解析】
A.已知:①C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1;②2CO(g)+O2(g)=2CO2(g) ΔH2=-566kJ·mol-1;③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH3=+141kJ·mol-1,则根据盖斯定律可知①×2-②+③即得到TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=2ΔH1-ΔH2+ΔH3,A正确;
B.有机物M经过太阳光光照可转化成N,ΔH=+88.6kJ·mol-1,这说明M的总能量低于N的总能量,则M比N更稳定,B错误;
C.已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1molN2(g)与3molH2(g)反应生成NH3(g)的反应热为(946+436×3-3×2×391)kJ/mol=-92kJ/mol,所以热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.0kJ·mol-1,C正确;
2NH3(g) ΔH=-92.0kJ·mol-1,C正确;
D.已知CH3OH(l)的燃烧热ΔH=-726.5kJ·mol-1,则CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-726.5kJ·mol-1,CH3OH(l)+
O2(g)=CO2(g)+2H2O(l) ΔH=-726.5kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-akJ·mol-1,由于氢气继续燃烧放热,则a<726.5,D正确。
O2(g)=CO2(g)+2H2(g) ΔH=-akJ·mol-1,由于氢气继续燃烧放热,则a<726.5,D正确。
答案选B。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.激素类药物乙烯雌酚的结构简式为: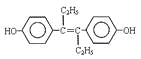 ,它的分子式是:C18H20O2
,它的分子式是:C18H20O2
B.等质量的甲烷、乙烯、乙醇分别充分燃烧,所耗用氧气的量依次减少
C.聚乳酸(![]() )是由单体之间通过加聚反应合成的
)是由单体之间通过加聚反应合成的
D.实验证实![]() 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键
可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁用于照明弹,是因为镁能在空气中燃烧产生耀眼光芒,并发生如下三个反应:
①2Mg+O2![]() 2MgO
2MgO
②3Mg+N2![]() Mg3N2
Mg3N2
③2Mg+CO2![]() 2MgO+C(黑色)。
2MgO+C(黑色)。
关于上述三个反应的叙述不正确的是( )
A.反应①②③的还原剂都是金属镁
B.反应①和③中都是氧元素被还原
C.反应②的生成物中氮元素为-3价
D.反应③的氧化剂是二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池是新型的绿色能源电池,其简化的生产工艺流程如下。
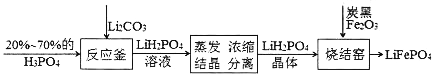
(1)反应釜中反应的化学方程式为_______,该反应体现出非金属性关系:P_____C(填“>”或“<”)。
(2)室温下,LiH2PO4溶液的pH随c(H2PO4-)的变化如图1所示,H3PO4溶液中H2PO4-的分布分数![]() 随pH的变化如图2所示[
随pH的变化如图2所示[![]() (含P元素的粒子)]。
(含P元素的粒子)]。
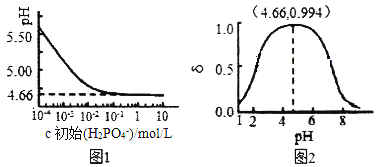
①由图1知,低浓度时LiH2PO4溶液的pH小于7,且随着c初始(H2PO4-)的增大而减小,其合理的解释为__________________。
②综合上图分析,若用浓度大于1mol/L的H3PO4溶液溶解Li2CO3,要使反应釜中的H3PO4几乎全部转化成LiH2PO4,反应釜中需要控制溶液的pH=________。
(3)磷酸铁锂电池总反应为:LiFePO4+6C![]() Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向______(填“阳极”或“阴极”);放电时,正极反应式为__________________。
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向______(填“阳极”或“阴极”);放电时,正极反应式为__________________。
(4)磷酸铁锂电池中铁的含量可通过如下方法测定:称取1.60g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.030mol/L重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液50.00mL。
已知:2Fe3++Sn2++6Cl-=SnCl62-+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
①实验中加入HgCl2饱和溶液的目的是____________。
②铁的百分含量Fe(%)=_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3是一种化工原料,可以通过反应生成一系列物质,如图所示。
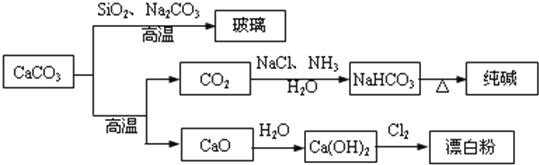
下列说法正确的是( )
A.![]() 和
和![]() 均可以漂白有色物质,且漂白的原理相同
均可以漂白有色物质,且漂白的原理相同
B.由 可知
可知![]() 的酸性强于
的酸性强于![]()
C.工业上,可先向饱和食盐水中通入![]() 后再通入
后再通入![]() 制
制![]()
D.制取玻璃、纯碱和漂白粉所涉及的反应都是非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收Cu并制备ZnO的部分实验过程如图所示:
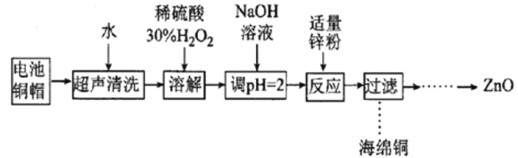
下列叙述错误的是
A. 合理处理废弃旧电池的铜帽既有利于节约资源,又有利于保护环境
B. “溶解”操作中可用酸性条件下不断鼓入O2代替H2O2
C. 加入锌粉反应的离子为Cu2+
D. “过滤”操作后直接将溶液蒸发结晶、高温灼烧得到ZnO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某活动课程小组拟用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入过量的CO2气体生成NaHCO3,设计了如下实验步骤:
a.取25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸溶液1~2 min,赶走溶解在溶液中的CO2气体;
c.在得到的溶液中加入另一半(25 mL)NaOH溶液,使其充分混合反应。
(1)此方案能制得较纯净的Na2CO3,写出c步骤的离子方程式_________。此方案第一步的实验装置如图所示:
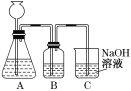
(2)加入反应物前,如何检验整个装置的气密性:___________。
(3)若用大理石与盐酸制CO2,则装置B中盛放的试剂是___________,作用是:_________。
(4)在实验室通常制法中,装置A还可作为下列_________(填序号)气体的发生装置。
①HCl ②H2 ③Cl2
(5)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44 g/mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为_____mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(s)+nB(g)![]() cC(g)+fD(g)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压强(P)的关系如图所示(T2>T1),下列叙述正确的是( )
cC(g)+fD(g)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压强(P)的关系如图所示(T2>T1),下列叙述正确的是( )

A.达到平衡后,若使用催化剂,C的体积分数增大
B.达到平衡后,若使温度升高,化学平衡向逆反应方向移动
C.化学方程式中n>c+f
D.达到化学平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,A、B、C、D为短周期主族元素,其中A、B、C在周期表中所处的位置如图所示,且它们的质子数之和为32。D元素原子的最外层电子数为次外层电子数的2倍。下列说法正确的是

A.原子半径:D>A>CB.常温常压下,B单质为固态
C.气态氢化物热稳定性:B>CD.C的最高价氧化物的水化物是强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com