
A、3Fe+4H2O(g)
| ||||
| B、Cl2+2OH-=Cl-+ClO-+H2O | ||||
| C、Ca(OH)2+SO2=CaSO3+H2O | ||||
D、Cu+2H2SO4(浓)
|


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
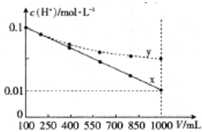 将c(H+)相等、体积均为100mL的两种一元酸x和y稀释,稀释过程中c(H+)与溶液体积的关系如图所示.若分别向上述两种酸中加入足量锌粒,反应后产生标准状况下气体的体积为Vx、Vy,则( )
将c(H+)相等、体积均为100mL的两种一元酸x和y稀释,稀释过程中c(H+)与溶液体积的关系如图所示.若分别向上述两种酸中加入足量锌粒,反应后产生标准状况下气体的体积为Vx、Vy,则( )| A、x为弱酸,Vx<Vy |
| B、x为强酸,Vx>Vy |
| C、y为弱酸,Vx<Vy |
| D、y为强酸,Vx>Vy |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+>Fe2+>Cu2+ |
| B、Fe3+>Cu2+>Fe2+ |
| C、Cu2+>Fe3+>Fe2+ |
| D、Fe2+>Cu2+>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150mL 1mol?L-1的NaCl溶液 |
| B、50mL 1mol?L-1的CaCl2溶液 |
| C、150mL 3mol?L-1的KCl溶液 |
| D、150mL 3mol?L-1的MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将SO2通入到NaClO溶液里:SO2+ClO-+H2O═SO42-+Cl-+2H+ |
| B、FeCl3溶液中加入铜屑:Cu+2Fe3+═Cu2++2Fe2+ |
| C、醋酸溶解水垢中的CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ |
| D、向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.3mol/L |
| B、0.45mol/L |
| C、0.4mol/L |
| D、0.6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com